问题
计算题
(20分)难溶化合物的饱和溶液存在溶解平衡,例如:AgCl(s) Ag++Cl-,Ag2CrO4(s)
Ag++Cl-,Ag2CrO4(s) 2Ag++
2Ag++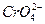 。在一定温度下,已知:Ksp(AgCl)=c(Ag+)·c(Cl-)=1.8×10-10,Ksp(Ag2CrO4)=[c(Ag+)]2·c(
。在一定温度下,已知:Ksp(AgCl)=c(Ag+)·c(Cl-)=1.8×10-10,Ksp(Ag2CrO4)=[c(Ag+)]2·c(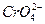 )=1.9×10-12,现用0.01 mol·L-1 AgNO3溶液滴定0.01 mol·L-1 KCl和0.001 mol·L-1 K2CrO4混合溶液,通过计算回答:
)=1.9×10-12,现用0.01 mol·L-1 AgNO3溶液滴定0.01 mol·L-1 KCl和0.001 mol·L-1 K2CrO4混合溶液,通过计算回答:
(1)Cl-、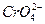 谁先沉淀?
谁先沉淀?
(2)当刚出现Ag2CrO4沉淀时,溶液中Cl-的物质的量浓度是多少?(设混合溶液在反应中体积不变)
答案
(1)Cl-先沉淀 (2)4.13×10-6 mol·L-1
(1)根据两种物质的Ksp,求出生成各自的沉淀所需的c(Ag+),比较两者c(Ag+),谁需c(Ag+)小谁先沉淀。
沉淀Cl-: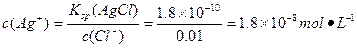 。
。
沉淀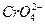 :
: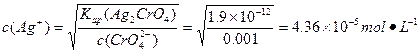 。
。
故先生成AgCl沉淀。
(2)因[c(Ag+)]2·c(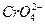 )=1.9×10-12,[c(Ag+)]2×0.001 mol·L-1=1.9×10-12,c(Ag+)=4.36×10-5 mol·L-1,c(Ag+)·c(Cl-)=1.8×10-10,4.36×10-5·c(Cl-)=1.8×10-10,c(Cl-)=4.13×10-6 mol·L-1。
)=1.9×10-12,[c(Ag+)]2×0.001 mol·L-1=1.9×10-12,c(Ag+)=4.36×10-5 mol·L-1,c(Ag+)·c(Cl-)=1.8×10-10,4.36×10-5·c(Cl-)=1.8×10-10,c(Cl-)=4.13×10-6 mol·L-1。
