酸、碱、盐都是重要的化合物,请回答下列有关问题。
(1)下列不属于复分解反应发生条件的是 (填字母)。
A.有水生成
B.有气体生成
C.有单质生成
D.有难溶物生成(2)观察右图,请简述闻浓盐酸气味的操作方法(或注意事项)。

(3)配制一定质量分数的氢氧化钠溶液,有关操作如下图所示:
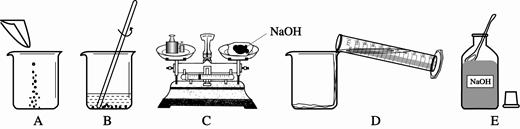
以上实验的正确操作顺序为 ;(用字母代号表示);其中B中的仪器名称是 ;C操作中出现的错误是 ;若C中砝码的质量为15g,游码的读数为3.5g,则氢氧化钠和纸片的实际总质量为 g。
(4)用pH试纸测定所配制溶液的酸碱度,应该如何操作?
(5)工业上常用氢氧化钠来中和废水中的盐酸,现取废液50g,逐滴滴入10%的氢氧化钠溶液中和,当溶液pH为7时,用去氢氧化钠溶液8g。计算废水中氯化氢的质量分数。
(1)C;
(2)用手在瓶口轻轻地扇动,让极少量气体飘进鼻孔(或不要把鼻孔凑到瓶口去闻气味);
(3)ECADB;玻璃棒和烧杯;砝码和被称量物质放颠倒了;11.5g;
(4)在白瓷板或玻璃片上放一小片pH试纸,将被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较,即可得出该溶液的酸碱度。
(5)1.46%
题目分析:(1)复分解反应是指由两种化合物反应,生成另外两种化合物的反应。复分解反应发生的条件是生成难溶物、气体或者水,因此选择C选项;
(2)闻浓盐酸气味时,要注意不能把鼻孔凑到瓶口去闻气味,而应用手在瓶口轻轻地扇动,让极少量气体飘进鼻孔即可;
(3)配制溶液的步骤是:称量→溶解,因此正确的操作顺序应该是ECADB,B中的仪器名称为玻璃棒和烧杯;C操作中砝码和被称量物质放颠倒了;若C中砝码的质量为15g,游码的读数为3.5g,则氢氧化钠和纸片的实际总质量为15g-3.5g="11.5g" ;
(4)用pH试纸测定所配制溶液的pH值的方法是:在白瓷板或玻璃片上放一小片pH试纸,将被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较,即可得出该溶液的pH值;
(5)解:设废液中氯化氢的质量为x。
NaOH + HCl=NaCl+H2O
40 36.5
8g×10% x
 =
=
x=0.73
氯化氢的质量分数为: ×100%=1.46%
×100%=1.46%
点评:该题考查的知识点较多,但难度不大,解答本题的关键在于了解复分解反应的定义,掌握基本实验操作,如配制溶液的步骤、溶液的酸碱度的测定,以及掌握化学方程式的计算。学生应注意化学用语的严谨、规范,注意计算过程要仔细。
