化学是一门以实验为基础的自然科学,初中化学课上做过许多实验,根据下 * * 个实验,回答问题:
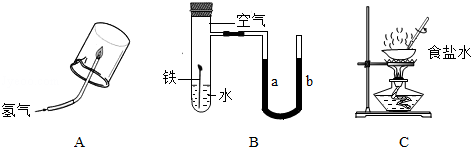
(1)A实验中先 ,再点燃氢气,以免发生爆炸.氢气燃烧的化学方程式是 .
(2)B实验中开始时U型管两端的红墨水液面相平,一段时间后,能观察到液面 端上升(填a或b),其原因是 .
(3)C实验中将氯化钠溶液蒸发至 后,应停止加热,并用玻璃棒继续搅拌,利用余热将余下溶液蒸发至干.
(1)检验氢气的纯度;2H2+O2 2H2O;(2)a;铁钉生锈消耗了试管内的氧气,使试管内压强低于大气压;(3)出现较多的固体.
2H2O;(2)a;铁钉生锈消耗了试管内的氧气,使试管内压强低于大气压;(3)出现较多的固体.
题目分析:(1)氢气具有可燃性,为防止发生爆炸,点燃氢气前应先检验氢气的纯度;氢气在点燃的条件下与氧气反应生成水,其化学反应方程式为:2H2+O2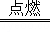 2H2O.
2H2O.
(2)铁钉处在潮湿的空气中易生锈,消耗了密闭试管内的氧气,使试管内压强减小,外界大气压不变,故U型管b端液面下降,a端侧液面上升.
(3)进行蒸发操作时,C实验中将氯化钠溶液蒸发至出现较多的固体后,应停止加热,利用余热将余下溶液蒸发至干.
点评:本题难度不大,掌握氢气的化学性质与验纯、铁锈蚀的条件、蒸发操作的注意事项等是正确解答本题的关键.
