(14分)下表是不同温度下水的离子积数据:
| 温度/℃ | 25 | t1 | t2 |
| Kw/ mol2·L-2 | 1×10-14 | a | 1×10-12 |
(1)若25< t1< t2,则a 1×10-14(填“<”、“>”或“=”),由此判断的理由是:
(2)在25 ℃下,pH=10的NaOH溶液中,水电离产生的[OH-]为:
(3)若某温度下,纯水中c(H+) = 5×10-7 mol·L-1,则此时纯水中的c(OH-)=_______________;若温度不变,滴入稀硫酸使c(H+)=5.0×10-3 mol·L-1,则c(OH-)=_______________。
(1)﹥ 水的电离为吸热反应,升高温度,平衡向着正反应方向移动,[H+]增大,[OH-]增大,Kw =c(H+)c(OH-),Kw增大
(2) 10-10mol·L-1
(3)5×10-7mol·L-1 5×10-11mol·L-1
考查水的电离
(1)水的电离平衡为:H2O H++OH-,属于吸热反应,升高温度,平衡向着正反应方向移动,[H+]增大,[OH-]增大,Kw =c(H+)c(OH-),Kw增大
H++OH-,属于吸热反应,升高温度,平衡向着正反应方向移动,[H+]增大,[OH-]增大,Kw =c(H+)c(OH-),Kw增大
(2)在碱溶液中,H+全部来自于水的电离,其浓度为10-10 mol·L-1
(3)纯水中,c(H+) =c(OH-)= 5×10-7 mol·L-1,Kw =c(H+)c(OH-)=2.5×10-13 mol·L-1;
若温度不变,Kw为定值,c(H+)=5.0×10-3 mol·L-1,则c(OH-)=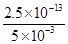 =5×10-11mol·L-1
=5×10-11mol·L-1
