(10分)(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________
A. KMnO4 B. H2O2 C. Cl2水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH不可选用下列中的________
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)
(1)B AB (2)4 3.3 可行
(1)提纯是为了除去杂质,又不引入杂质,可采用H2O2自理,过氧化氢为绿色氧化剂,本身还原为水,不污染环境且不引入新杂质。
调整溶液的PH时为了不引入新杂质,可选用C、D选项,即不可选用A、B;
(2)溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的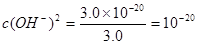 ;即
;即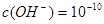 ,即可得此时溶液的pH=4;Fe3+完全沉淀时,
,即可得此时溶液的pH=4;Fe3+完全沉淀时,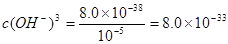 ;即
;即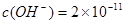 ,即可求得溶液的pH=3.3。所以,当溶液pH=4时,Cu(OH)2开始沉淀而氢氧化铁则早已沉淀完全,可以该方案可行。
,即可求得溶液的pH=3.3。所以,当溶液pH=4时,Cu(OH)2开始沉淀而氢氧化铁则早已沉淀完全,可以该方案可行。
