某自来水中含有Ca2+、Mg2+、Na+、K+、、HCO32-、SO42-、Cl—,长期烧煮上述自来水会在锅炉内形成水垢。锅炉水垢不仅耗费燃料,而且有烧坏锅炉的危险,因此要定期清除锅炉水垢。已知部分物质20℃时的溶解度数据为:

(1)请用化学方程式表示锅炉中的水垢含有Mg(OH)2的原因:_________________________ 。
(2)锅炉中的水垢所含有的CaSO4不能直接用酸除去,需要加入试剂X,使其转化为易溶于盐酸的物质Y而除去。试剂X是_____________ (填序号)。
A.食醋
B.氯化钡
C.碳酸钠
D.碳酸氢钠(3)水中的Ca2+、Mg2+可以用一定浓度的M溶液进行测定,M与Ca2+、Mg2+都以等物质的量进行反应。现取含Ca2+浓度为0.40g/L的自来水样10mL,至锥形瓶中进行滴定,达到终点时,用去了浓度为0.01mol/L的M溶液20.00 mL,则该自来水样中Mg2+的物质的量浓度是______________________________。
(1)Mg(HCO3)2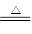 MgCO3↓+H2O+CO2↑, MgCO3+H2O
MgCO3↓+H2O+CO2↑, MgCO3+H2O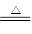 Mg(OH)2+CO2↑
Mg(OH)2+CO2↑
(2)C (3)0.01mol/L
(1)因为在加热的条件下碳酸氢镁会分解生成碳酸镁,继续加热,碳酸镁可以和水发生水解反应生成氢氧化镁。
(2)钙的碳酸盐易溶于盐酸,所以可加入碳酸钠,生成碳酸钙而除去。
(3)10ml自来水中含有钙离子的物质的量是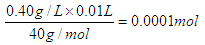 ,
,
同时消耗M也是0.0001mol。M总的物质的量是0.01mol.L×0.02L=0.0002mol,所以和镁离子反应的M是0.0002mol-0.0001mol=0.0001mol,则镁离子是0.0001mol,所以其浓度为