(6分)某种工业废水中含有一定量的Cr2O72-和CrO42-,它们易被人体吸收积累而导致肝癌。污水处理厂常用还原沉淀法处理含铬废水,其流程如下:
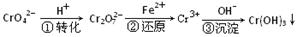
(1)已知第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
①Cr2O72-中Cr的化合价是 。
②若平衡体系的pH=10,则溶液显 色。
(2)第②步发生反应的离子方程式为 _______ ,还原1mol Cr2O72—离子,需要_______mol的FeSO4·7H2O;
(3)常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
(1)① +6 (1分) ②黄(1分)
(2)6Fe2++ Cr2O72- + 14H+= 6Fe3++ 2Cr3+ + 7H2O (2分) 6 (1分)(3)5 (1分)
(1)①根据化合价的代数和为0可知,Cr的化合价是+(2×7-2)÷2=+6价。
②pH=10,说明溶液显碱性,平衡向逆反应方向移动,所以溶液显黄色。
(2)根据反应物可知,亚铁离子被氧化生成铁离子,所以方程式为6Fe2++ Cr2O72- + 14H+= 6Fe3++ 2Cr3+ + 7H2O。根据方程式可知,还原1mol Cr2O72—离子,需要6mol亚铁离子。
(3)根据溶度积常数表达式可知c(OH-)=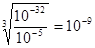 ,所以pH应该调节至5。
,所以pH应该调节至5。
