问题
选择题
常温下,0.1 mol·L-1某一元酸(HA)溶液中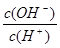 =1×10-8,下列叙述正确的是( )
=1×10-8,下列叙述正确的是( )
A.溶液中水电离出的c(H+)=10-10 mol·L-1
B.溶液中c(H+)+c(A-)=0.1 mol·L-1
C.与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中离子浓度大小关系为:c(A-)>c(Na+)>c(OH-)>c(H+)
D.上述溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
答案
答案:D
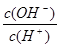 =1×10-8,则根据水的离子积常数可知,溶液中氢离子浓度是10-3mol/L,这说明酸是弱酸。溶液中OH-的浓度是10-11mol/L,溶液中水电离出的c(H+)=10-11mol/L,A不正确。B不正确,根据物料守恒应该是c(HA)+c(A-)=0.1 mol·L-1。根据电荷守恒可知c(A-)+c(OH-)=c(Na+)+c(H+),所以选项C是不正确的,因此正确的答案选D。
=1×10-8,则根据水的离子积常数可知,溶液中氢离子浓度是10-3mol/L,这说明酸是弱酸。溶液中OH-的浓度是10-11mol/L,溶液中水电离出的c(H+)=10-11mol/L,A不正确。B不正确,根据物料守恒应该是c(HA)+c(A-)=0.1 mol·L-1。根据电荷守恒可知c(A-)+c(OH-)=c(Na+)+c(H+),所以选项C是不正确的,因此正确的答案选D。
