问题
选择题
定量分析中可用AgNO3溶液滴定Cl-溶液,加入K2CrO4为指示剂,达到滴定终点时溶液体积为50mL,c(Cl-) = 10-5 mol·L-1,AgNO3与CrO42- 生成砖红色的Ag2CrO4沉淀。已知Ksp(AgCl) = 1.77×10-10,Ksp(AgI) = 8.51×10-17,Ksp(Ag2CrO4) = 1.12×10-12,根据以上实验操作和有关数据,下列说法正确的是
A.常温下,向含AgCl固体的AgCl溶液中加入NaCl固体,AgCl沉淀的量不变
B.滴定终点时,溶液中CrO42-的浓度约为3.6×10-3 mol·L-1
C.向10mL0.1moL/L AgNO3溶液中滴加3—5滴0.1moL/L NaCl溶液生成AgCl沉淀,再滴加KI溶液,生成AgI沉淀,能够说明Ksp(AgI)< Ksp(AgCl)
D.可用0.1 mol·L-1的KI溶液代替K2CrO4做指示剂
答案
答案:B
A不正确,增大氯离子浓度会析出氯化银晶体。到达终点是溶液中c(Cl-) = 10-5 mol·L-1,所以银离子浓度是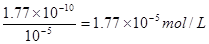 ,因此溶液中CrO42-的浓度
,因此溶液中CrO42-的浓度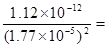 3.6×10-3 mol·L-1,B正确。C不正确,因为硝酸银是过量的,滴入碘化钾和硝酸银反应生成碘化银沉淀。D不正确,因为碘化银的溶度积常数小于氯化银的,首先生成的沉淀是碘化银,而不是氯化银,答案选B。
3.6×10-3 mol·L-1,B正确。C不正确,因为硝酸银是过量的,滴入碘化钾和硝酸银反应生成碘化银沉淀。D不正确,因为碘化银的溶度积常数小于氯化银的,首先生成的沉淀是碘化银,而不是氯化银,答案选B。
