氢氟酸是一种弱酸,可用来刻蚀玻璃,已知25℃时:
HF(aq) + OH—(aq) 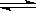 F—(aq) + H2O(l) △H=-67.7 kJ/mol
F—(aq) + H2O(l) △H=-67.7 kJ/mol
H+(aq) + OH—(aq) 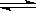 H2O(l) △H=-57.3kJ/mol
H2O(l) △H=-57.3kJ/mol
在10 mL 0.1mol/L的NaOH溶液中,加入10 mL 浓度为c mol/L的HF稀溶液,下列说法中错误的是
A.当氢氟酸溶液温度升高,HF的电离程度减小(不考虑挥发)
B.水电离的热化学方程式为:H2O(1) 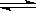 H+(aq)+OH—(aq);△H= +57.3kJ/mol
H+(aq)+OH—(aq);△H= +57.3kJ/mol
C.当c > 0.1时,一定不存在:c(Na+) = c(F—)
D.若混合后溶液中:c(Na+)>c(OH—) >c(F—)>c(H+),则c一定小于0.1
答案:C
题目分析:C项:因为HF是弱酸,弱电解质,部分电离,当F-的水解程度等于多余的HF的电离程度时,可以出现c(Na+) = c(F—)。故错。故选C。
点评:本题考查的是盐类的水解的相关知识,强酸弱碱盐水解呈酸性,强碱弱酸盐水解呈碱性,另外需注意在溶液中会存在盐类的水解和弱电解质的电离都有的情况。
