(16分) (1)将2mol SO2和1mol O2放入2L密闭容器中发生如下反应:
2SO2+O2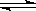 2SO3△H<0
2SO3△H<0
当达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,如下图表示:
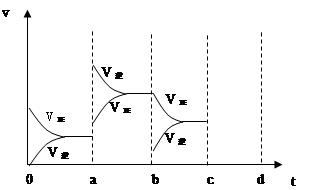
(1)a b过程中改变的条件可能是 ;
(2)b c过程中改变的条件可能是 ;
(3)若增大压强时,反应速度变化情况画在c~d处;
(4) 达到第一个平衡时,测得平衡时SO3的浓度为0.5mol/L。请计算此条件下的平衡常数和SO2的转化率。(要求写出解题过程)
(共16分)
(1)升温; (2)减小 SO3浓度;
(3) 如图(各2分,)
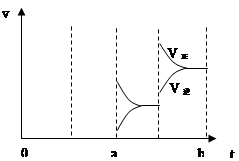
(4) 4; 50% (共10分)
题目分析:将2mol SO2和1mol O2放入2L密闭容器中发生如下反应:
2SO2+O2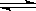 2SO3△H<0
2SO3△H<0
a—b的变化,可以看到,正逆反应速率都发生了突跃,而且,逆反应速率大于正反应速率,由于该反应放热,所以ab的条件改变是升温,b—c的变化,逆反应速率突跃下降,正反应速率连续降低,改变的条件可能是减小 SO3浓度;
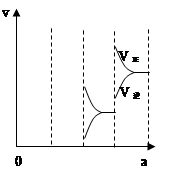
若增大压强时,反应速度变化情况如上图:
达到第一个平衡时,测得平衡时SO3的浓度为0.5mol/L。
2SO2 + O2 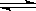 2SO3△H<0
2SO3△H<0
起始浓度 1 0.5 0
变化浓度 0.5 0.25 0.5
平衡浓度 0.5 0.25 0.5
此条件下的平衡常数K=C2(SO3)/C2(SO2)*C(O2) =4。
SO2的转化率=0.5/1=50%。
点评:化学平衡常数,是指在一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡,这时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值是个常数,用K表示,这个常数叫化学平衡常数。平衡常数一般有浓度平衡常数和压强平衡常数。
在书写平衡常数表达式时,要注意以下问题:
① 在应用平衡常数表达式时,稀溶液中的水分子浓度可不写。因为稀溶液的密度接近于1 g/mL。水的物质的量浓度为55.6 mol/L。在化学变化过程中,水量的改变对水的浓度变化影响极小,所以水的浓度是一个常数,此常数可归并到平衡常数中去。
对于非水溶液中的反应,溶剂的浓度同样是常数。
② 当反应中有固体物质参加时,分子间的碰撞只能在固体表面进行,固体的物质的量浓度对反应速率和平衡没有影响,因此,固体的“浓度”作为常数,在平衡常数表达式中,就不写固体的浓度。
③ 化学平衡常数表达式与化学方程式的书写方式有关。同一个化学反应,由于书写的方式不同,各反应物、生成物的化学计量数不同,平衡常数就不同。但是这些平衡常数可以相互换算。
④ 不同的化学平衡体系,其平衡常数不一样。平衡常数大,说明生成物的平衡浓度较大,反应物的平衡浓度相对较小,即表明反应进行得较完全。因此,平衡常数的大小可以表示反应进行的程度。
⑤一般认为K>10^5反应较完全(即不可逆反应),K<10^(-5)反应很难进行(即不反应)。
平衡常数的数值大小可以判断反应进行的程度。
