铁是地壳中含量第二的金属元素,其单质、合金及化合物在生产生活中的应用广泛。
(―)工业废水中含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的危害,必须进行处理。常用的处理方法是电解法,该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解的进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(1)用Fe作电极的目的是 。
(2)阴极附近溶液pH升高的原因是_ (用电极反应式解释);溶液中同时生成的沉淀还有 。
(二)氮化铁磁粉是一种磁记录材料,利用氨气在400℃以上分解得到的氮原子渗透到高纯铁粉中可制备氮化铁。制备高纯铁粉涉及的主要生产流程如下:
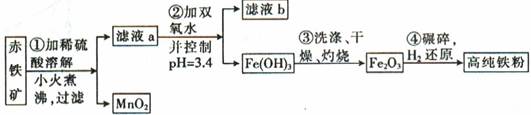
已知①某赤铁矿石含60.0%Fe2O3、3.6%FeO,还含有Al2O3、MnO2、CuO等。
②部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下:

(3)步骤②中加双氧水的目的是 ,pH控制在3.4的作用是 ,已知25℃时,Ksp[Cu(OH)2] =2.0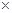 10-20,该温度下反应:Cu2++2H2O
10-20,该温度下反应:Cu2++2H2O Cu(OH)2+2H+的平衡常数K= 。
Cu(OH)2+2H+的平衡常数K= 。
(4)如何判断步骤③中沉淀是否洗涤干净? 。
(5)制备氮化铁磁粉的反应:Fe+NH3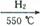 FexNy+H2 (未配平),若整个过程中消耗氨气34.0g,消耗赤铁矿石2kg,设整个过程中无损耗,则FexNy磁粉的化学式为 。
FexNy+H2 (未配平),若整个过程中消耗氨气34.0g,消耗赤铁矿石2kg,设整个过程中无损耗,则FexNy磁粉的化学式为 。
(1)提供还原剂Fe2+
(2)2H++2e-=H2↑(或2H2O-2e-=H2+2OH-);Fe(OH)3
(3)将溶液中的Fe2+氧化为Fe3+;使溶液中的Fe3+完全沉淀,而其他金属离子不沉淀;5.0×10-9
(4)取少量最后一次洗涤液于试管中,滴加BaCl2溶液,若有白色沉淀生成,则表明沉淀没有洗净;若无沉淀生成,则表明已洗净。
(5)Fe8N
题目分析:(1)根据题意,Cr2O72-和CrO42-被还原为Cr3+,因此需要还原剂,而Fe作电极电解时产生的Fe2+具有还原性,Fe2+被氧化为Fe3+。
(2)电解时,阴极H+放电产生H2,剩余OH-,溶液显碱性。溶液中的金属离子除了Cr3+,还有Fe3+,因此还会生成Fe(OH)3。
(3)根据流程图,沉淀只有Fe(OH)3,为使铁离子完全沉淀,需将Fe2+转化为Fe3+,加双氧水是为了将Fe2+氧化为Fe3+。根据金属离子沉淀时的pH,可知控制pH=3.4,是为了使铁完全沉淀,而其他离子不沉淀,得到纯净的铁的化合物。反应平衡常数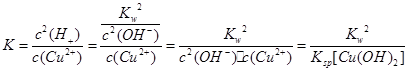 ,代入数据可得K=5.0×10-9。
,代入数据可得K=5.0×10-9。
(4)流程中第一步用硫酸溶解固体,故检验沉淀是否洗净,可检验沉淀中是否含有SO42-。
(5)2kg矿石中的含铁量为: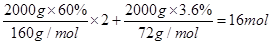 ,氨气的物质的量为
,氨气的物质的量为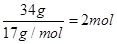 ,即反应中n(Fe):n(NH3)=8:1,因此反应的化学方程式为16Fe+2NH3
,即反应中n(Fe):n(NH3)=8:1,因此反应的化学方程式为16Fe+2NH3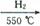 2Fe8N+3H2。
2Fe8N+3H2。