氨的合成原理为:N2(g)+3H2(g) 2NH3(g) ;△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如右图。回答下列问题:
2NH3(g) ;△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如右图。回答下列问题:
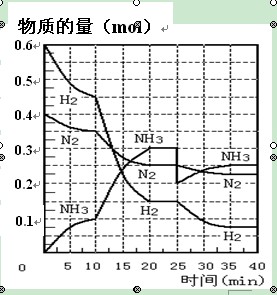
(1)10 min内以NH3表示的平均反应速率 ;
(2)在10 ~20 min内:NH3浓度变化的原因可能是 ;
A.加了催化剂
B.缩小容器体积
C.降低温度
D.增加NH3物质的量(3)第1次平衡的时间范围为: 平衡常数K1 ="_____________" (表达式),第2次平衡时NH3的体积分数 ;
(4)在反应进行至25 min时, 曲线发生变化的原因:
(12分,每空2分)(1) v = 0.005 mol·L-1 ·min-1 (没有单位不给分)
(2) AB (漏选得1分,错选不给分)
(3): 20~25 min K1 = 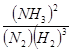 45.5 %
45.5 %
(4) 移走0.1 mol NH3(没有指出0.1mol的给1分)
题目分析:(1)根据图像可知,10min时氨气的物质的量是0.1mol,所以氨气的反应速率是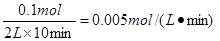 。
。
(2)根据图像可知,在10 ~20 min内NH3浓度增加,氮气和氢气的浓度减小,这说明反应向正反应方向进行。因为该反应是体积减小的、放热的可逆反应,所以改变的条件可能是缩小容器体积或降低温度,答案选BC。
(3)根据图像可知,在20 ~25 min内各种物质的浓度不再发生变化,即反应达到平衡状态,所以第1次平衡的时间范围为20 ~25 min。化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的方程式可知,该反应的平衡常数K1=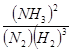 ;同样根据图像可知,反应进行到35min时,各种物质的浓度不再发生变化,即反应达到平衡状态。此时氢气、氮气和氨气的物质的量分别是0.075mol、0.225mol、0.25mol,所以第2次平衡时NH3的体积分数是
;同样根据图像可知,反应进行到35min时,各种物质的浓度不再发生变化,即反应达到平衡状态。此时氢气、氮气和氨气的物质的量分别是0.075mol、0.225mol、0.25mol,所以第2次平衡时NH3的体积分数是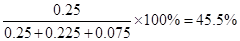 。
。
(4)根据图像可知,在25 min时,氨气的物质的量由0.3mol降低到0.2mol,所以改变的条件是移走了0.1molNH3。
点评:该题是中等难度的试题,也是高考中的常见题型。试题综合性强,侧重对学生能力的培养。试题在注重基础知识巩固,侧重对学生解题方法的指导与训练。有利于调动学生的学习兴趣和学习积极性。
