菱镁矿是碱性耐火材料的主要原料,其主要的化学成分是:MgCO3,同时含有杂质:SiO2、Al2O3、Fe2O3、CaO等;目前以菱镁矿为主要原料制备MgSO4的方法如下:
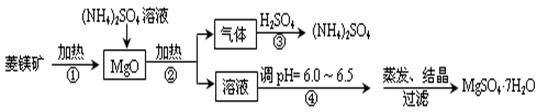
已知:①常温下,Fe3+、Al3+、Mg2+开始形成氢氧化物沉淀和沉淀完全时的pH值如下:
| Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀 | 2.1 | 3.7 | 9.0 |
| 沉淀完全 | 3.2 | 5.2 | 12.4 |
(1)用平衡原理解释:菱镁矿粉粹后加热生成的氧化镁可以溶解在硫酸铵溶液中的原因 。
(2)在该工业流程中,可以循环使用的物质是 。
(3)步骤③中氨气和硫酸恰好完全反应,取此时所得的溶液10.00mL配成250mL溶液,配制溶液过程中除烧杯、玻璃棒、胶头滴管、酸式滴定管外,还需要的玻璃仪器有: ;经检测所配制的溶液pH=1,c(SO42ˉ)=1.05mol/L,试求算所配制溶液中NH4+ 水解的平衡常数K(写计算过程,计算结果保留三位有效数字)。
(4)在加热条件下杂质中的三氧化二铁溶于硫酸铵的离子反应方程式是:
。
(5)蒸发结晶过程中需要使用60~70℃水浴加热方式,其原因是 。
(16分)
(1)因NH4++H2O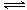 NH3·H2O+H+,MgO+ 2H+=Mg2++H2O,氧化镁消耗氢离子,铵根离子水解平衡向右进行,不断提供H+使MgO不断溶解(3分)(写出两个方程式就给2分,平衡向右移动给1分)
NH3·H2O+H+,MgO+ 2H+=Mg2++H2O,氧化镁消耗氢离子,铵根离子水解平衡向右进行,不断提供H+使MgO不断溶解(3分)(写出两个方程式就给2分,平衡向右移动给1分)
(2)(NH4)2SO4(2分)
(3)250ml容量瓶(2分,没有规格不给分) K=5.00×10-3 mol•Lˉ1(计算过程见解析)
(4)Fe2O3+ 6NH4+ =6NH3↑+2Fe3++3H2O(条件:加热)(没有写条件和气体呼号扣1分,没配平扣1分;共2分)
(5)避免加热蒸发过程中MgSO4·7H2O失去部分或全部的结晶水(2分)
题目分析:(1)硫酸铵溶液中存在如下水解平衡:NH4++H2O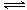 NH3•H2O+H+,氧化镁与氢离子反应,生成镁离子和水,减小氢离子浓度,促进铵根离子的水解平衡右移,生成的氢离子又溶解菱镁矿粉粹后加热生成的氧化镁;(2)步骤③生成硫酸铵,步骤②消耗硫酸铵,说明该工艺流程中,硫酸铵是可以循环利用的物质;(3)配制250mL溶液需要的玻璃仪器是烧杯、玻璃棒、250mL容量瓶、胶头滴管、酸式滴定管等;氨气和硫酸反应所得溶液中含有H+、NH4+、OH-,根据电荷守恒原理可得:c(H+)+c(NH4+)=2c(SO42ˉ),由于pH=1,则溶液中c(H+)=0.1mol/L,c(SO42ˉ)=1.05mol/L,所以c(NH4+)=2.0mol/L;由于(NH4)2SO4=2NH4++SO42ˉ,则没有水解时c(NH4+)="2" c(SO42ˉ)=2.1mol/L;由三行数据法得:
NH3•H2O+H+,氧化镁与氢离子反应,生成镁离子和水,减小氢离子浓度,促进铵根离子的水解平衡右移,生成的氢离子又溶解菱镁矿粉粹后加热生成的氧化镁;(2)步骤③生成硫酸铵,步骤②消耗硫酸铵,说明该工艺流程中,硫酸铵是可以循环利用的物质;(3)配制250mL溶液需要的玻璃仪器是烧杯、玻璃棒、250mL容量瓶、胶头滴管、酸式滴定管等;氨气和硫酸反应所得溶液中含有H+、NH4+、OH-,根据电荷守恒原理可得:c(H+)+c(NH4+)=2c(SO42ˉ),由于pH=1,则溶液中c(H+)=0.1mol/L,c(SO42ˉ)=1.05mol/L,所以c(NH4+)=2.0mol/L;由于(NH4)2SO4=2NH4++SO42ˉ,则没有水解时c(NH4+)="2" c(SO42ˉ)=2.1mol/L;由三行数据法得:
NH4++H2O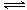 NH3•H2O+H+
NH3•H2O+H+
各组分起始浓度/mol•Lˉ1 2.1 0 0
各组分变化浓度/mol•Lˉ1 0.1 0.1 0.1
各组分平衡浓度/mol•Lˉ1 2.0 0.1 0.1
K=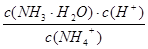 =
=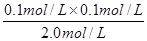 =5.00×10-3 mol•Lˉ1;
=5.00×10-3 mol•Lˉ1;
(4)先写硫酸铵水解反应:NH4++H2O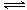 NH3·H2O+H+,再写Fe2O3+6H+=2Fe3++3H2O,前者×6+后者可得:Fe2O3+6NH4++3H2O=6NH3·H2O+2Fe3+,加热时6NH3·H2O
NH3·H2O+H+,再写Fe2O3+6H+=2Fe3++3H2O,前者×6+后者可得:Fe2O3+6NH4++3H2O=6NH3·H2O+2Fe3+,加热时6NH3·H2O  6NH3+6H2O,则Fe2O3+6NH4+=6NH3↑+2Fe3++3H2O;(5)蒸发结晶得到的目标产物是MgSO4·7H2O,加热温度过低,蒸发结晶速率过低,加热温度过高,结晶析出的MgSO4·7H2O失去部分或全部的结晶水,因此蒸发结晶过程中需要使用60~70℃水浴加热方式。
6NH3+6H2O,则Fe2O3+6NH4+=6NH3↑+2Fe3++3H2O;(5)蒸发结晶得到的目标产物是MgSO4·7H2O,加热温度过低,蒸发结晶速率过低,加热温度过高,结晶析出的MgSO4·7H2O失去部分或全部的结晶水,因此蒸发结晶过程中需要使用60~70℃水浴加热方式。
