化学能与电能之间的相互转化与人的生活实际密切相关,在生产、生活中有重要的应用,同时也是学生形成化学学科素养的重要组成部分。
(1)熔融状态下,钠的单质和氯化亚铁能组成可充电电池(如图1),反应原理为:2Na+FeCl2 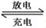 Fe+2NaCl,该电池放电时,正极反应式为 ________________ _____:
Fe+2NaCl,该电池放电时,正极反应式为 ________________ _____:

充电时,__________(写物质名称)电极接电源的负极;
该电池的电解质为________ _。
(2)某同学用铜片、石墨作电极电解一定浓度的硫酸铜溶液(如图2),一段时间停止通电取出电极。若在电解后的溶液中加入0.98g氢氧化铜粉末恰好完全溶解,经测定所得溶液与电解前完全相同。请回答下列问题:
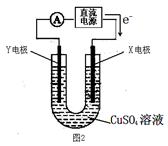
①Y电极材料是 ,发生 (填“氧化或还原”)反应。
②电解过程中X电极上发生的电极反方应式是:
③如在电解后的溶液中加入足量的小苏打,充分反应后产生气体在标准状况下所占的体积是
(3)常温时,BaSO4的Ksp=1.08×10-10,现将等体积的BaCl2溶液与2.0×10-3mol/l的Na2SO4
溶液混合。若要生成BaSO4沉淀,BaCl2溶液的最小浓度为______________。
(14分)
(1)Fe2++2e-= Fe(2分),钠(1分),β—Al2O3(1分)
(2)①石墨(1分),氧化(1分)
②Cu2++2e-=Cu(2分)、2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-(2分)
③0.448L或448mL(2分)没有单位扣1分
(3)2.16x10-7. (2分)
题目分析: (1)对氧化还原反应,含化合价降低的元素发生还原反应做正极。充电时负极连接阴极。能导电的做电解质溶液。
(2)由加入0.98g氢氧化铜粉完全溶解,所得溶液与电解前完全相同。可知溶液电解氢氧化铜,在阴极放电的是Cu2+,在阳极放电的是OH-。小苏打(NaHCO3)
Cu SO4 + 2 H2O= Cu(OH)2+H2SO4 n=0.98g/98gmol-1=0.01mol
2NaHCO3+H2SO4=Na2SO4+H2O+2CO2↑
0.01mol 0.02mol
0.02mol×22.4L/mol=0.448L
(3) 等体积的BaCl2溶液与2.0×10-3mol/l的Na2SO4溶液混合
Ksp=c(Ba2+)c(SO42-)=c(Ba2+)1.0×10-3=1.08×10-10
c(Ba2+)=1.08×10-7 c原(Ba2+)=2.16x10-7.
