问题
选择题
25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.6×10-9。该温度下,下列说法不正确的是
A.同浓度的Na2SO4和Na2CO3混合溶液中滴加BaCl2溶液,BaSO4先析出
B.BaCO3的悬浊液中加入少量的新制氯水,c(Ba2+)增大
C.BaSO4和BaCO3共存的悬浊液中,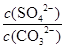 =
=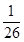
D.BaSO4悬浊液中加入Na2CO3浓溶液,BaSO4不可能转化为BaCO3
答案
答案:D
题目分析:A、Ksp(BaSO4)<Ksp(BaCO3),所以同浓度的Na2SO4和Na2CO3混合溶液中滴加BaCl2溶液,BaSO4先析出,A正确;B、BaCO3的悬浊液中加入少量的新制氯水,氯水显酸性,消耗溶液中的CO32-,促进碳酸钡的溶解平衡,因此c(Ba2+)增大,B正确;C、BaSO4和BaCO3共存的悬浊液中,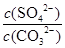 =
=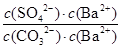 =
=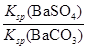 =
=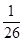 ,C正确;D、只要溶液中c(CO32-) ·c(Ba2+)>Ksp(BaCO3)就可以形成碳酸钡沉淀,所以BaSO4悬浊液中加入Na2CO3浓溶液,BaSO4有可能转化为BaCO3,D不正确,答案选D。
,C正确;D、只要溶液中c(CO32-) ·c(Ba2+)>Ksp(BaCO3)就可以形成碳酸钡沉淀,所以BaSO4悬浊液中加入Na2CO3浓溶液,BaSO4有可能转化为BaCO3,D不正确,答案选D。
