工业生产Na2S常用方法是无水芒硝(Na2SO4)一碳还原法,其流程示意图如下:
(1)若煅烧阶段所得气体为等物质的量的CO和CO2。写出煅烧时发生的总反应方程式:______________________。
(2)用碱液浸出产品比用热水更好,理由是__________________。
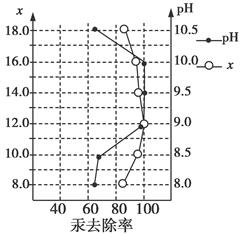
(3)废水中汞常用硫化钠除去,汞的除去率与溶液pH和硫化钠实际用量与理论用量比值x的关系如图所示。为使除汞达到最佳效果,应控制条件是________________。
(4)取Na2S(含少量NaOH),加入到CuSO4溶液中,充分搅拌,若反应后溶液pH=4,此时溶液中c(S2-)=________mol·L-1[已知:CuS的Ksp=8.8×10-36;Cu(OH)2的Ksp=2.2×10-20(保留2位有效数字)]。
(5)纳米Cu2O常用电解法制备,制备过程用铜棒和石墨棒做电极,Cu(NO3)2做电解液。电解生成Cu2O应在________;该电极pH将________(填“升高”“不变”或“降低”),用电极方程式解释pH发生变化的原因______________________。
(1)3Na2SO4+8C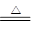 3Na2S+4CO2↑+4CO↑
3Na2S+4CO2↑+4CO↑
(2)热水能促进Na2S水解,而稀碱可抑制Na2S水解
(3)pH介于9~10之间,x=12
(4)4.0×10-36 mol/L
(5)阴极 降低
2Cu2++2e-+H2O=Cu2O↓+2H+
(1)由题意分析知反应除生成等物质的量的CO和CO2外还生成Na2S,注意条件为加热。(2)Na2S是强碱弱酸盐,水解后溶液显碱性,加热会促进S2-水解,而加碱则可以抑制其水解。(3)由图像可知当pH介于9~10时,x=12时汞的除去率最大。(4)pH=4,则c(OH-)=10-10 mol/L,根据Cu(OH)2溶度积可求得c(Cu2+)=2.2 mol/L,代入CuS的溶度积求得c(S2-)=4×10-36 mol/L。(5)Cu由+2价变为+1价,得电子,所以在阴极反应:2Cu2++2e-+H2O=Cu2O↓+2H+,有H+生成,所以溶液的pH降低。
点拨:本题考查化学与技术,考查考生理论联系实际的能力。难度较大。

 =25%,
=25%, =15%,
=15%, =60%,在P=0.196 MPa时的露点约为()。
=60%,在P=0.196 MPa时的露点约为()。