铬污染主要产生于铬矿的开采和冶炼。工厂排出的铬渣成分为SiO2、 A12O3、MgO、 Fe2O3、Na2Cr2O7等,其中危害最大的化学成分是Na2Cr2O7。已知:① Na2Cr2O7易溶于水,是强氧化剂。② +6价铬易被人体吸收,可致癌;+3价铬不易被人体吸收,毒性小。下面是实验室模拟处理铬渣、消除铬污染的工艺流程如下(部分操作和条件略):
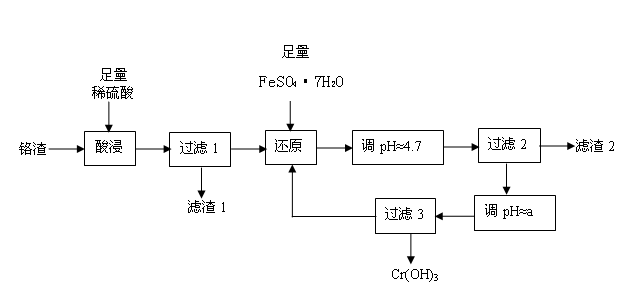
(1)在酸浸过程中,稀H2SO4溶解A12O3的离子方程式是 。
(2)过滤1后的滤液中存在如下平衡:Cr2O72-(橙色)+ H2O  2CrO42-(黄色)+ 2H+,此时溶液应呈现的颜色是 。
2CrO42-(黄色)+ 2H+,此时溶液应呈现的颜色是 。
(3)用FeSO4·7H2O还原 Na2Cr2O7的离子方程式是 。
(4)已知:生成氢氧化物沉淀的pH
| 物质 | Fe(OH)3 | Al(OH)3 | Cr(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 1.5 | 3.4 | 4.9 | 6.3 | 9.6 |
| 完全沉淀 | 2.8 | 4.7 | 5.5 | 8.3 | 12.4 |
根据表中数据,流程中的a为 。
(5)分离滤渣2中物质,发生反应的离子方程式是 。
(6)过滤3所得滤液又回流到过滤1所得滤液中,其目的是 。
(1)A12O3+6H+=2Al3++3H2O(1分)
(2)橙色 (1分)
(3)6Fe2++ Cr2O72-+14H+="6" Fe3++2 Cr3++7H2O (2分)
(4)5.5<=a<6.3 (1分)
(5)Al(OH)3+OH-=Al02-+2H2O; (2分 )
(6)目的是使还原剂FeSO4循环使用。 (1分 )
题目分析:(1)稀H2SO4溶解A12O3的离子方程式是:A12O3+6H+=2Al3++3H2O
(2)滤液中H+浓度增大平衡逆向移动,所以溶液呈橙色;
(3)FeSO4·7H2O被 Na2Cr2O7氧化成硫酸铁,离子方程式是6Fe2++ Cr2O72-+14H+="6" Fe3++2 Cr3++7H2O
(4)调节pH为4.7时已将Al3+、Fe3+全部沉淀,所以过滤之后再调pH应使Cr3+沉淀完全,但不能使残留的Fe2+沉淀,因此a的范围是5.5<=a<6.3
(5)滤渣2的成分是氢氧化铁与氢氧化铝,用氢氧化钠溶液分离,发生的离子方程式为Al(OH)3+OH-=Al02-+2H2O;
(6)过滤3所得滤液成分主要是硫酸亚铁,又回流到过滤1所得滤液中,其目的是使还原剂FeSO4循环使用。
