(15分)
制烧碱所用盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
Ⅰ. 向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ. 向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ. 滤液用盐酸调节pH,获得一次精制盐水。
(1)过程Ⅰ除去的离子是______。
(2)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
② 过程Ⅰ选用BaCl2而不选用CaCl2,运用表中数据解释原因______。
③ 除去Mg2+的离子方程式是______。
④ 检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测Ba2+即可,原因是_____。
(3)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如下:
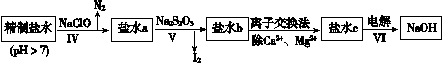
① 过程Ⅳ除去的离子是______。
② 盐水b中含有SO42-。Na2S2O3将IO3- 还原为I2的离子方程式是______。
③ 过程VI中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释:_______。
(15分)
(1)SO42-
(2)① 取少量过程II后的滤液于试管中,滴加几滴KSCN 溶液,若溶液不变红,说明
Fe 3+已除尽;反之没除尽
② BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完全
③ 2Mg2+ + 2CO32- + H2O ="=" Mg2(OH)2CO3↓+ CO2↑
④ 在BaCO3、CaCO3、Mg2(OH)2CO3中,BaCO3的溶解度最大,若Ba2+沉淀完全,则说明Mg2+和Ca2+也沉淀完全
(3)① NH4+、I-
② 5S2O32- + 8IO3- + 2OH- ="=" 4I2 + 10SO42- + H2O
③ H+在阴极上得电子变成H2逸出,使H2O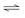 H+ +OH-电离平衡向右移动,OH-在阴极区浓度增大,Na+向阴极区移动,最后NaOH在阴极区生成
H+ +OH-电离平衡向右移动,OH-在阴极区浓度增大,Na+向阴极区移动,最后NaOH在阴极区生成
题目分析:(1)BaCl2溶液与粗盐水中的SO42-离子反应生成硫酸钡沉淀,所以过程Ⅰ除去的离子是SO42-离子;
(2)①检测Fe3+是否除尽的方法是取少量过程II后的滤液于试管中,滴加几滴KSCN 溶液,若溶液不变红,说明Fe 3+已除尽;反之没除尽;
②从表中数据可知,BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完全
③ 溶液中的Mg2+与CO32-发生水解而生成沉淀,除去镁离子的离子方程式为2Mg2+ + 2CO32- + H2O ="=" Mg2(OH)2CO3↓+ CO2↑
④ 检测沉淀是否完全,只需检测溶解度较大的沉淀即可。在BaCO3、CaCO3、Mg2(OH)2CO3中,BaCO3的溶解度最大,若Ba2+沉淀完全,则说明Mg2+和Ca2+也沉淀完全;
(3)①过程Ⅳ加入NaClO,有N2放出,说明过程Ⅳ除去的离子是NH4+;
②Na2S2O3将IO3- 还原为I2,本身被还原成SO42- +,离子方程式为 5S2O32- + 8IO3- + 2OH- ="=" 4I2 + 10SO42- + H2O;
③ H+在阴极上放电变成H2逸出,使H2O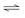 H+ +OH-电离平衡向右移动,使阴极区OH-离子浓度增大,Na+向阴极区移动,最后NaOH在阴极区生成。
H+ +OH-电离平衡向右移动,使阴极区OH-离子浓度增大,Na+向阴极区移动,最后NaOH在阴极区生成。
