[14分]已知:I2+2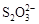

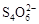 +2I―。相关物质的溶度积常数见下表:
+2I―。相关物质的溶度积常数见下表:
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体。
(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,原因是_______________。(用化学方程式表示)。由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是_______。
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I―发生反应的氧化性质杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用___________作滴定指示荆,滴定终点的现象是_________________。
②CuCl2溶液与KI反应的离子方程式为______________________________。
③该试样中CuCl2•2H2O的质量百分数为___________________________。
(14分)
(1)Cu(OH)2或Cu2(OH)2CO3
2.6×10-9 mol·L-1
(2)2CuCl2·2H2O Cu(OH)2·CuCl2+2HCl+2H2O(主要产物写成Cu(OH)2、Cu(OH)Cl、CuO均可)
Cu(OH)2·CuCl2+2HCl+2H2O(主要产物写成Cu(OH)2、Cu(OH)Cl、CuO均可)
在干燥的HCl气流中加热脱水
(3)①淀粉溶液
蓝色褪去,放置一定时间后不复色
②2Cu2++4I-=2CuI↓+I2
③95%
(1)CuO (2)CuCl2+H2O CuO+2HCl↑CuCl2•2H2O晶体在HCl气流中加热脱水
CuO+2HCl↑CuCl2•2H2O晶体在HCl气流中加热脱水
(1)调节溶液pH时不应该带入其它杂质,故可选择CuO或CuCO3等固体消耗溶液中的H+,使其pH升高;当溶液的pH=4时,c(H+)=1×10-4 mol/L,c(OH-)=1×10-10 mol/L,由Fe(OH)3的Ksp计算可得c(Fe3+)=Ksp/ c3(OH-) =2.6×10-39/1×10-30=2.6×10-9 mol/L。(2)由于CuCl2在加热过程中水解被促进,且生成的HCl又易挥发而脱离体系,造成水解完全,碱式氯化铜或氢氧化铜,以至于得到CuO固体,而不是CuCl2,2CuCl2·2H2O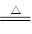 Cu(OH)2·CuCl2+2HCl+2H2O;想得到无水CuCl2的合理方法是,让CuCl2•2H2O晶体在干燥的HCl气流中加热脱水。(3)滴定前的处理过程中将发生下列反应:2Cu2++4I-=2CuI↓+I2,滴定过程中I2消失是滴定的终点,所以可选用淀粉溶液做指示剂,滴定终点为:蓝色褪去,且在半分钟内不恢复颜色;从反应2Cu2++4I-=2CuI↓+I2,I2+2S2O32-=S4O62-+2I-,可知Cu2+~S2O32-,n(Cu2+)="0.100" mol/L×0.020 L=2×10-3 mol,m(CuCl2·2H2O) =2×10-3 mol×171 g/mol =0.342g,则试样中CuCl2·2H2O的含量为95%。
Cu(OH)2·CuCl2+2HCl+2H2O;想得到无水CuCl2的合理方法是,让CuCl2•2H2O晶体在干燥的HCl气流中加热脱水。(3)滴定前的处理过程中将发生下列反应:2Cu2++4I-=2CuI↓+I2,滴定过程中I2消失是滴定的终点,所以可选用淀粉溶液做指示剂,滴定终点为:蓝色褪去,且在半分钟内不恢复颜色;从反应2Cu2++4I-=2CuI↓+I2,I2+2S2O32-=S4O62-+2I-,可知Cu2+~S2O32-,n(Cu2+)="0.100" mol/L×0.020 L=2×10-3 mol,m(CuCl2·2H2O) =2×10-3 mol×171 g/mol =0.342g,则试样中CuCl2·2H2O的含量为95%。
【考点定位】本题考查Ksp计算、滴定和物质制备。

