问题
填空题
常温下,浓度均为0.1 mol/L的6种溶液pH如下:
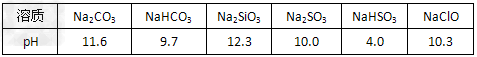
请由上表数据回答:
(1)非金属性Si______C(填“>”或“<”),用原子结构解释其原因:同主族元素由上到下 ___________________。
(2)常温下,相同物质的量浓度的下列稀溶液,其酸性由强到弱的顺序是____________(填序号) 。
a.H2SiO3 b.H2SO3 c.H2CO3
(3)用离子方程式说明Na2CO3溶液pH>7的原因_____________。
(4)6种溶液中,水的电离程度最小的是_____________(填化学式) 。
(5)若增大氯水中次氯酸的浓度,可向氯水中加入上表中的物质是(填化学式)_________,用化学平衡移动的原理解释其原因:___________________。
答案
(1)<;原子半径逐渐增大,得电子能力逐渐减弱
(2)bca
(3)CO32-+H2O HCO3-+OH-
HCO3-+OH-
(4)NaHSO3
(5)NaHCO3(或NaClO);因为Cl2 + H2O H++Cl-+HClO, NaHCO3(或NaClO)消耗H+,平衡正向移动,使溶液中次氯酸浓度增大
H++Cl-+HClO, NaHCO3(或NaClO)消耗H+,平衡正向移动,使溶液中次氯酸浓度增大
