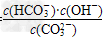问题
填空题
现有常温下的0.1 mol/L纯碱溶液.
(1)你认为该溶液呈碱性的原因是(用离子方程式表示):______________________.为证明你的上述观点,请设计一个简单的实验,简述实验过程. ___________________________.
(2)同学甲认为该溶液中Na2CO3的水解是微弱的,发生水解的CO32-不超过其总量的10%.请你设计实验证明该同学的观点是否正确____________
(3)同学乙就该溶液中粒子之间的关系写出了下列四个关系式,你认为其中正确的是________.
A.c(Na+)=2c(CO32-)
B.c(CO32-)>c(OH-)>c(HCO3-)>c(H2CO3)
C.c(CO32-)+c(HCO3-)=0.1 mol/L
D.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
(4)水解反应是典型的可逆反应.水解反应的化学平衡常数称为水解常数(用Kh表示),请写出Na2CO3第一步水解反应的水解常数的表示式________________.
答案
(1)CO32-+H2O HCO3-+OH- ;向纯碱溶液中滴加数滴酚酞试液后,溶液显红色;然后逐滴加入氯化钙溶液直至过量,若溶液红色逐渐变浅直至消失,则说明上述观点
HCO3-+OH- ;向纯碱溶液中滴加数滴酚酞试液后,溶液显红色;然后逐滴加入氯化钙溶液直至过量,若溶液红色逐渐变浅直至消失,则说明上述观点
(2)用pH试纸(或pH计)测常温下0.1 mol/L纯碱溶液的pH,若pH12,则该同学的观点不正确
(3)BD
(4)Kh=