根据Fe3++Ag⇌Fe2++Ag+,可用Fe3+的盐溶液做刻蚀液将试管中的银镜洗去.
(1)FeCl3溶液显酸性,原因是______(用离子方程式表示).
(2)关于FeCl3溶液洗银后的相关叙述正确的是______(填序号).
a.c(Fe3+)减小 b. c(Cl-)不变 c.铁元素质量减小
(3)Fe(NO3)3溶液洗银时,甲同学认为NO3-也能将银氧化.他认为可以通过检验Fe(NO3)3溶液洗银后NO3-的还原产物来判断NO3-是否能将银氧化,而乙同学认为此方法不______可行,乙同学的理由是______.
(4)乙同学欲从洗银废液(Fe3+、Fe2+、Ag+、NO3-)中回收银和刻蚀液,设计了如下路线:
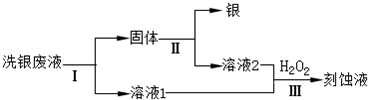
①过程Ⅰ中反应的离子方程式是______.
②过程Ⅱ中加入的试剂可以是______.
(5)镀银后的银氨溶液放置时会析出有强爆炸性的物质,所以不能贮存.从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2.
①生成AgCl沉淀的化学方程式是______.
②若该反应中消耗3.3g羟氨,理论上可得银的质量为______g.
(1)FeCl3溶液显酸性是因为铁离子水解生成氢氧化铁和氢离子;反应的离子方程式为:Fe3++3H2O⇌Fe(OH)3+3H+;
故答案为:Fe3++3H2O⇌Fe(OH)3+3H+;
(2)FeCl3溶液洗银,发生反应为:Fe3++Ag⇌Fe2++Ag+,
a.c(Fe3+)减小 故a符合;
b. c(Cl-)不变,故b不符合;
c.铁元素存在形式不同但质量不会减小,故c不符合;
故答案为:a;
(3)通过检验Fe(NO3)3溶液洗银后NO3-的还原产物来判断NO3-是否能将银氧化,需要在酸溶液中,亚铁离子也会反应;
故答案为:酸性条件下NO3-也可能与Fe2+发生氧化还原反应;
(4)①洗银废液(Fe3+、Fe2+、Ag+、NO3-)中回收银和刻蚀液需要先加入过量铁还原Fe3+、Ag+;反应的离子方程式为:2Fe3++Fe=3Fe2+Fe+2Ag+=Fe2++2Ag;
故答案为:2Fe3++Fe=3Fe2+Fe+2Ag+=Fe2++2Ag;
②过程Ⅱ中加入的试剂是溶解过量的铁,可以用稀盐酸或稀硫酸;
故答案为:稀盐酸或稀硫酸;
(5)①银氨溶液中加入过量盐酸生成氯化银,同时生成氯化铵和水,反应的化学方程式为:Ag(NH3)2OH+3HCl=AgCl↓+2NH4Cl+H2O;
故答案为:Ag(NH3)2OH+3HCl=AgCl↓+2NH4Cl+H2O;
②向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2.反应为:2AgCl+2NH2OH=N2↑+2Ag+2H2O+2HCl,反应中消耗3.3g羟氨物质的量=
=0.1mol;生成银物质的量为0.1mol,质量为10.8g;3.3g 33g/mol
故答案为:10.8;
