完成下列各题:

①该反应在0~10min时间内H2的平均反应速率为______,N2的转化率为______
②在T1℃时,若起始时在容器甲中加入0.5molN2、1.5molH2、1molNH3,则达到平衡时NH3的物质的量为( )(填选项字母)
a、大于0.4mol b、等于0.4mol c、小于于0.4mol
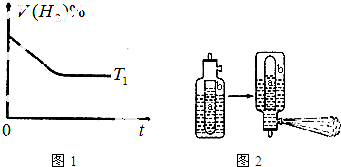
③如图1是在T1℃时密闭容器甲中H2的体积分数随时间t的变化曲线,请在图中补画出该反应在t2℃(T2>T1)时的H2体积随时间t的变化曲线.
(2)已知:Al3+与HCO3-、CO32-、HS-、S2-等能发生彻底的双水解,生活中通常利用Al3+与HCO3-的反应来制作泡沫灭火器.泡沫灭火器的简易构造如图2,a为玻璃瓶,b为铁筒,请思考:
①参与反应的液体分别为Al2(SO4)3和NaHCO3,请问a瓶中盛放的液体为:______.
②为了保证泡沫灭火器的使用寿命,通常在Al2(SO4)3溶液中加入另一种物质抑制硫酸铝的水解,请问该物质是______.
③已知苯酚是比碳酸更弱的酸,请问,苯酚钠和硫酸铝能否发生彻底的双水解?如能,请写出该反应的离子反应方程式:______.
(1)①、平衡时氨气的物质的量为0.4mol,由方程式可知参加反应的氢气的物质的量为0.4mol×
=0.6mol,参加反应的氮气的物质的量为0.4mol×3 2
=0.2mol,故v(H2)=1 2
=0.03mol/(L•min),氮气的转化率为0.6mol 2L 10min
×100%=20%,故答案为:0.03mol/(L•min),20%;0.2mol 1mol
②、恒温恒容下,起始时在容器甲中加入0.5molN2、1.5molH2、1molNH3,按化学计量数转化到左边有1molN2、3molH2,与原平衡为等效平衡,平衡时对应各组分的物质的量相等,达到平衡时NH3的物质的量为0.4mol,故答案为:b;
③、该反应正反应是放热反应,升高温度,反应速率加快,到达平衡的时间缩短,平衡向逆反应移动,H2体积分数增大,该反应在t2℃(T2>T1)时的H2体积随时间t的变化曲线图为:
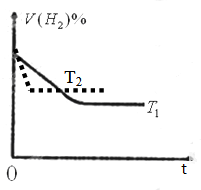
,
故答案为:

;
(2)①、若把Al2(SO4)3放在铁筒里,因发生水解反应:Al3++3H2O⇌Al(OH)3+3H+,溶液呈酸性会腐蚀铁筒,故a瓶中盛放的液体为Al2(SO4)3溶液,故答案为:Al2(SO4)3溶液;
②、Al2(SO4)3溶液中铝离子水解成酸性,故可以加入硫酸,抑制铝离子水解,故答案为:硫酸;
③、苯酚的酸性比碳酸还弱,氢氧化铝不能溶于苯酚,苯酚钠和硫酸铝可以发生彻底的双水解,生成氢氧化铝沉淀与苯酚,反应离子方程式为Al3++3C6H5O-+3H2O=Al(OH)3↓+3C6H5OH↓,
故答案为:能,Al3++3C6H5O-+3H2O=Al(OH)3↓+3C6H5OH↓.
