问题
选择题
下列叙述中,不正确的是
A.0.1 mol?L-1 CH3COOH溶液加水稀释,n(H+)增大
B.0.2 mol?L-1盐酸与等体积0.05 mol?L-1 Ba(OH)2溶液混合后,溶液pH为1
C.向含等浓度的KCl和KI的混合溶液,滴加少量AgNO3溶液生成黄色沉淀,说明同温度下Ksp(AgCl)大于Ksp(AgI)
D.若NH4HCO3溶液、NH4HSO4溶液和NH4NO3溶液中c(NH4+)相等,则c(NH4HSO4) < c(NH4NO3) < c(NH4HCO3)
答案
答案:B
A选项加水弱电解质越稀越电离,n(H+)增大,A正确;B混合后c(H+)=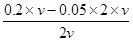 ="0.05" mol?L-1,B错误;C生成黄色沉淀说明AgI溶解度更小,所以同温度下Ksp(AgCl)大于Ksp(AgI),C正确;D假设三溶液等浓度,NH4HSO4电离出的H+抑制NH4+的水解,而NH4HCO3中NH4+和HCO3—的水解相互促进,而NH4NO3中只有NH4+水解,此时c(NH4+):c(NH4HCO3) < c(NH4NO3)< c(NH4HSO4),故当溶液中c(NH4+)相等时正好反着,D正确。
="0.05" mol?L-1,B错误;C生成黄色沉淀说明AgI溶解度更小,所以同温度下Ksp(AgCl)大于Ksp(AgI),C正确;D假设三溶液等浓度,NH4HSO4电离出的H+抑制NH4+的水解,而NH4HCO3中NH4+和HCO3—的水解相互促进,而NH4NO3中只有NH4+水解,此时c(NH4+):c(NH4HCO3) < c(NH4NO3)< c(NH4HSO4),故当溶液中c(NH4+)相等时正好反着,D正确。
