问题
填空题
回答下列各小题:
(1)已知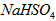 在水中的电离方程式为
在水中的电离方程式为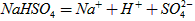 。在
。在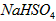 溶液
溶液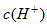
__________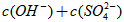 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
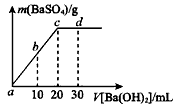
(2)常温下,向1.0mol/L的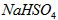 溶液中逐滴加入等物质的量浓度的
溶液中逐滴加入等物质的量浓度的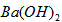 溶液,生产沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点表示溶液呈_________(填“酸性”“中性”或“碱性”),c点所示的离子方程式为___________________。
溶液,生产沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点表示溶液呈_________(填“酸性”“中性”或“碱性”),c点所示的离子方程式为___________________。
(3)在T℃时,将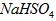 晶体加入到pH=6的蒸馏水中,保持温度不变,测得溶液的pH为2。T℃将
晶体加入到pH=6的蒸馏水中,保持温度不变,测得溶液的pH为2。T℃将
__________25℃(填“高于”或“低于”),Kw为________,在该溶液中由水电离出的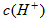 为
为
_________mol·L-1。T℃时,将pH=11的NaOH溶液V1L与pH=1的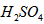 溶液V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1: V2 =____________,此溶液中各种离子的浓度由大到小的排列顺序为_________________________。
溶液V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1: V2 =____________,此溶液中各种离子的浓度由大到小的排列顺序为_________________________。
(4)0.1 mol·L-1pH为4的NaHB溶液中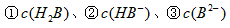 由大到小的顺序为
由大到小的顺序为
_______________。
(5)在0.1 mol·L-1的①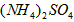 溶液、②
溶液、②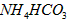 溶液、③
溶液、③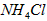 溶液中,
溶液中,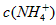 由大到小的排列顺序为_____________________。
由大到小的排列顺序为_____________________。
答案
(1)=
(2)中性;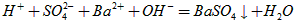
(3)高于;10-12;10-10;9:11;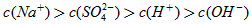
(4)②>③>①
(5)①>③>④>②
