(1)某温度(t℃)时,水的Kw=10-13,则该温度(填 “大于”“小于”或“等于”)____25℃,其理由是
___________________。将此温度下pH =11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,
①若所得混合液为中性,则a:b___________
②若所得混合液的pH=2,则a:b___________
(2)某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A=H++HA-;HA- H++A2-
H++A2-
①Na2A溶液显____(填“酸性”“中性”或“碱性”),用一个等式表示0.1mol/L的Na2A溶液中所有离子间的关系___________;
②已知0.1mol/L NaHA溶液的pH =2,0.1 mol/L NaHA溶液中各种离子浓度由大到小的顺序是___________
(1)大于;水的电离反应:H2O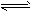 H++OH-是吸热反应,升温有利于水的电离,使Kw增大
H++OH-是吸热反应,升温有利于水的电离,使Kw增大
①10:1;②9:2
(2)①碱性;c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-);②c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)