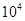(8分)A、B代表不同物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合.要求:相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度。
(1)写出化学式A1________,A2________,B1________,B2________;
(2)相同温度下,当A1、B1的物质的量浓度相等时,两溶液中水电离出的氢离子的物质的量浓度之比为_______________________ _;
(3)写出0.1 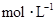 的
的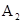 溶液中离子浓度大小排序 ________________;
溶液中离子浓度大小排序 ________________;
(4)B1溶液中水的电离程度小于B2溶液中水的电离程度,原因是 ________________;
(5)若B1、B2两溶液的pH=5,则两溶液中水电离出的氢离子的物质的量浓度之比为__________。
(1)NaOH 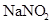
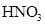
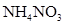
(2)1∶1
(3)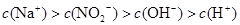
(4)硝酸电离的氢离子抑制了水的电离(1分),铵根离子的存在促进了水的电离
(5)1×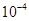 ∶1 (或1∶
∶1 (或1∶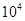 )
)
(1)A1 溶液中的水的电离程度小于A2 溶液中水的电离程度,说明A1是碱,A2是盐水解显碱性。B1 溶液中的水的电离程度小于B2溶液中水的电离程度,同样可知B1是酸,B2是盐水解显酸性。所以正确的组合是A1 NaOH A2 NaNO2 B1 HNO3 B2 NH4NO3
(2)等浓度的NaOH 、HNO3溶液中前者的OH—浓度与后者的H+浓度相等,对水的电离平衡:H2O H++OH-的抑制作用相当,故两溶液中水电离出的氢离子的物质的量浓度之比为1:1
H++OH-的抑制作用相当,故两溶液中水电离出的氢离子的物质的量浓度之比为1:1
(3) NaNO2溶液,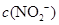 部分水解,溶液呈碱性,故
部分水解,溶液呈碱性,故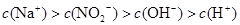
(4)硝酸电离出的H+抑制水的电离,而硝酸铵电离出的NH4+水解,促进水的电离
(5)硝酸溶液中的OH—全部来自于水的电离,即1×10—9mol/L,而硝酸铵溶液中的H+全部来自于水的电离,其浓度为1×10—5mol/L,故两溶液中水电离出的氢离子的物质的量浓度之比为1×10—9:1×10—5=1∶