(11分)研究和开发CO2和CO的创新利用是环境保护和资源利用的双赢的课题。
(1)CO可用于合成甲醇。在压强为0.1Mpa条件下,在体积为bL的密闭容器中充入amolCO和2amolH2,在催化剂作用下合成甲醇:
CO(g)+2H2(g) CH3OH(g)平衡时CO的转化率与温度,压强的关系如下图:
CH3OH(g)平衡时CO的转化率与温度,压强的关系如下图:
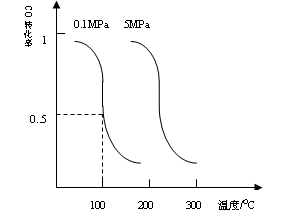
(i)该反应属于_____________反应:(填“吸热”或“放热”)。
(ii)100℃时,该反应的平衡常数:K=_____________;(用a、b的代数式表示)。
若一个可逆反应的平衡常数K值很大,对此反应的说法正确的是:_________________填序号)
A.该反应使用催化剂意义不大;
B.该反应发生将在很短时间内完成;
C.该反应达到平衡时至少有一种反应物百分含量很小;
D.该反应一定是放热反应;(iii)在温度和容积不变的情况下,再向平衡体系中充入amolCO,2amolH2,达到平衡时CO转化率________(填“增大”,“不变”或“减小”,下同)平衡常数:________。
(iv)在某温度下,向一容积不变的密闭容器中充入2.5molCO,7.5molH2,反应生成CH3OH(g),达到平衡时,CO转化率为90%,此时容器内压强为开始时的压强__________倍。
(2)某温度条件下,若将CO2(g)和H2(g)以体积比1:4混合,在适当压强和催化剂作用下可制得甲烷,已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ/mol
H2(g)+1/2O2(g)= H2O(l) △H=-285.8KJ/mol
则CO2(g)和H2(g)反应生成液态水的热化学方程式为:_________________________。
(1)(i)放热 (ii)b2/a2 C (iii)增大 不变 (iv)0.55
(2)CO2(g)+4 H2(g)= CH4(g)+ 2H2O(l)△H="-252.9" KJ/mol
(i)压强一定时,升温CO的转化率降低,即平衡左移,正反应为放热反应
(ii)0.1Mpa、100℃条件下,在体积为bL的密闭容器中达到平衡时,CO的转化率为0.5:
反应中:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
初n: a 2a 0
△n: 0.5a a 0.5a
平衡n:0.5a a 0.5a
故K=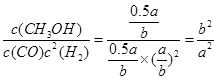
若一个可逆反应的平衡常数K值很大,只能说明正反应的趋势很大,与其反应历程(是否使用催化剂)、是否放热、反应速率无关;由平衡常数的概念可知,该反应达到平衡时至少有一种反应物百分含量很小,选C
(iii)在温度和容积不变的情况下,再向平衡体系中充入amolCO,2amolH2,相当于加压,达到平衡时,CO的转化率增大,但平衡常数只与温度有关,其值不会改变
(iv)由“三段式”来判定:
反应中:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
初n: 2.5 7.5 0
△n: 2.25 4.5 2.25
平衡n: 0.25 3 2.25
在容积不变的情况下,压强比等物质的量比,故达到平衡时,容器内压强为开始时的压强的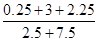 =0.55倍
=0.55倍
(本小题可通过差量法来计算,更加简洁)
(2)由所给两热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ/mol
②H2(g)+1/2O2(g)= H2O(l) △H=-285.8KJ/mol
根据盖斯定律可知②×4-①,得CO2(g)+4 H2(g)= CH4(g)+ 2H2O(l)△H="-252.9" KJ/mol
