问题
填空题
(6分)(1)某温度下,纯水中c(H+) = 5×10-7 mol·L-1,则此时纯水中的c(OH-) =" ____" mol·L-1;若温度不变,滴入稀硫酸使c(H+) = 5.0×10-3 mol·L-1,则c(OH-) =" ____" mol·L-1。
(2)已知室温下pH=2的高碘酸(H5IO6)溶液与pH=12的NaOH溶液等体积混合,所得混合溶液呈酸性,则高碘酸的电离方程式是__________________________。
答案
(1)5.0×10-7 mol·L-1 5.0×10-11 mol·L-1
(2)H5IO6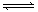 H+ +H4IO6-
H+ +H4IO6-
(1)在任何纯水中都显中性,即c(OH-) = c(H+) = 5×10-7 mol·L-1。所以在该温度下水的离子积常数为2.5×10-13 。因此当溶液中c(H+) = 5.0×10-3 mol·L-1时,c(OH-) =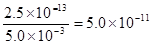 mol·L-1。
mol·L-1。
(2)pH=2的高碘酸(H5IO6)溶液与pH=12的NaOH溶液中c(H+)和c(OH-)都是0.01 mol·L-1,等体积混合后的溶液显酸性,这说明高碘酸是弱酸,存在电离平衡。
