(8分)CuSO4固体粉末中含有FeSO4杂质。取该固体粉末10g,全部溶于水中配成100g溶液,向其中加入过量纯铁粉,充分反应后过滤,得到滤液A和沉淀A,经测定沉淀A中只含两种金属单质。向沉淀A中加入过量盐酸,充分反应后再过滤,得沉淀B,沉淀B经洗涤、干燥后,称其质量为3.2g。计算:
(1)原固体粉末中CuSO4的质量;
(2)滤液A中溶质的质量分数(计算结果精确到0.1%)
(1)7.6克
(2)9.6%
解(1)设CuSO4的质量为x,生成的FeSO4的质量为y
CuSO4 + Fe =" " FeSO4 + Cu 1分
160 152 64
x y 3.2g
 2分
2分
解得x="8g " 1分
y="7.6g "
(2)原FeSO4的质量为:10g-8g="2g "
滤液A中FeSO4的质量:2g+7.6g="9.6g " 1分
滤液A中水的质量:100g-10g="90g " 1分
滤液A中FeSO4的质量分数为: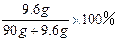 1分
1分
≈9.6% 1分
答:原固体粉末中CuSO4的质量为8g,滤液A中溶质的质量分数约为9.6%
