问题
计算题
(2010浙江宁波37)为了测定某种黄铜(铜和锌的合金)的组成,取该黄铜样品碎屑100g,把400g稀硫酸分4次加入到该样品中,测得数据记录如下表:
| 第1次 | 第2次 | 第3次 | 第4次 | |
| 加人稀硫酸质量(g) | 100 | 100 | 100 | 100 |
| 剩余固体质量(g) | 87 | 74 | 67.5 | 67.5 |
(1)第2次测得剩余固体质量为74g,其成分为 ▲ 。
A.铜 B.锌 C.铜和锌
(2)该黄铜样品中铜和锌的质量比m铜:m锌: ▲ 。
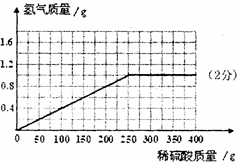
(3)计算所用稀硫酸的溶质质量分数,并画出反应生成的氢气质量与加入稀硫酸质量的关系图。
答案


:(1)锌、铜两种金属中只有锌能与酸发生反应,第2次加入稀硫酸完全反应后剩余固体质量为74g,第3次加入稀硫酸固体质量还能减少说明第二次反应后剩余固体中仍有锌;
(2)第四次加入酸固体质量不再减少说明锌已完全反应剩余固体全部是铜,故铜的质量为67.5g,所以该黄铜样品中铜和锌的质量比为:67.5g:(100g-67.5g)=27:13;
故答案为:27:13;
(3)依据题意,第一次中参加反应的锌的质量为100g-87g=13g,设参加反应的H2SO4质量为x
Zn+H2SO4=ZnSO4+H2↑
65 98
13g x
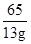 =
=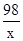
x=19.6g
则所用稀硫酸的溶质质量分数=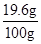 ×100%=19.6%
×100%=19.6%