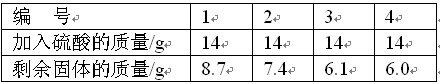
(11分)某合金可能由铜与镁、锌中的一种组成,现欲测定其组成,进行如下实验:取该合金样品10.0 g放入烧杯中,然后将56.0 g溶质质量分数为14.0%的稀硫酸平均分四次依次加入该烧杯中,每次均充分反应。实验数据记录如下表:
试求:
(1)该合金中铜的质量分数是__________。
(2)该合金除了铜外,另一种金属的是什么呢?(写出过程)
(3)第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是多少?(写出计算过程,结果精确到0.1%)
(160.0%
(2)设M金属单质的相对原子质量为x。
M+H2SO4===MSO4+H2↑
x 98
10.0 g-6.1 g 42.0 g×14.0%
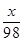 =
=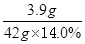
x=65
该金属是锌。
(也可选取第一次或第二次实验的数据计算)
(3) 解:设第三次所得溶液中ZnSO4的质量为y,生成H2的质量为z。
Zn+H2SO4===ZnSO4+H2↑
98 161 2
42.0 g×14.0% y z
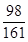 =
=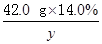
y=9.66 g
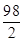 =
=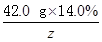
z=0.12 g
ZnSO4溶液中溶质质量分数为
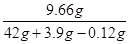 ×100%≈21.1%
×100%≈21.1%
(也可选取Zn的实验数据计算)
答:略。
分析:(1)根据金属活动性,铜不与硫酸反应,第4次加入稀硫酸固体质量减少量小于前三次,说明所剩余固体全部为铜,铜与样品质量比可计算该合金中铜的质量分数;
(2)利用前三次反应所消耗硫酸的质量,由反应中金属质量与硫酸质量关系,计算出金属的相对原子质量,根据金属的相对原子质量判断金属;
(3)根据反应的化学方程式,由硫酸质量计算生成硫酸盐的质量、放出氢气的质量,硫酸盐的质量与反应后溶液质量比可计算所得溶液中溶质的质量分数;其中反应后溶液质量可利用质量守恒定律计算求得.
解答:解:(1)铜不与硫酸反应,根据实验数据可知,样品中铜的质量为6.0g,该合金中铜的质量分数=
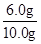 ×100%=60.0%
×100%=60.0%
故答案为:60.0%;
(2)(取到第三次的实验数据为准)设M金属单质的相对原子质量为x.
参加反应的金属的质量=10.0g-6.1g=3.9g.而参加反应的硫酸溶液的质量为14g×3=42g.
M+H2SO4═MSO4+H2↑
x 98
3.9g 42.0g×14.0%
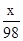 =
=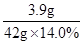
x="65" 因此该金属是锌.
(也可选取第一次或第二次实验的数据计算)
(3)设第三次所得溶液中ZnSO4的质量为y,生成H2的质量为z.
Zn+H2SO4 ═ZnSO4+H2↑
98 161 2
42.0g×14.0% y z
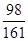 =
=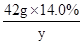
y=9.66g
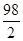 =
=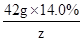
z=0.12g
ZnSO4溶液中溶质质量分数=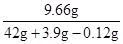 ×100%≈21.1%
×100%≈21.1%
(也可选取Zn的实验数据计算)
答:(2)该合金除了铜外,另一种金属的是锌;(3)第三次加入硫酸充分反应后,所得溶液中溶质的质量分数约为21.1%.
点评:根据质量守恒定律,第三次加入硫酸充分反应后,所得溶液的质量=参加反应金属的质量+前三次所加稀硫酸的质量-放出氢气的质量
