(6分)某化学兴趣小组欲检验当地石灰石中碳酸钙的纯度。在实验室将25克石灰石样品(杂质不参加反应,也不溶于水)放入盛有100克稀盐酸的烧杯中,恰好完全反应。测得烧杯中物质的总质量为116.2克。求:
(1)生成二氧化碳的质量。
(2)样品中碳酸钙的质量分数。
(3)所用稀盐酸中溶质的质量分数。
(6分)
解:生成二氧化碳的质量=25 g+100 g-116.2 g=8.8 g(1分)
设:样品中CaCO3的质量为x,所用稀盐酸中HCl的质量为y。
CaCO3+2HCl===CaCl2+H2O+CO2↑(1分)
100 73 44
x y 8.8 g
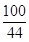 =
=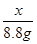 x=
x=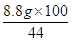 =20 g(1分)
=20 g(1分)
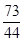 =
=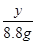 y=
y=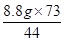 =14.6 g(1分)
=14.6 g(1分)
样品中碳酸钙的质量分数=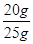 ×100%=80%(1分)
×100%=80%(1分)
所用稀盐酸中溶质的质量分数=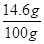 ×100%=14.6%(1分)
×100%=14.6%(1分)
答:生成二氧化碳的质量为8.8 g,样品中碳酸钙的质量分数为80%,所用稀盐酸中溶质的质量分数为14.6%。
分析:分析所发生的反应,可发现反应后总质量减轻是由于生成了气体二氧化碳,因此,可知恰好完全反应时放出二氧化碳的质量为8.8g;然后利用二氧化碳的质量,根据反应的化学方程式,分别计算恰好完全反应时碳酸钙的质量和HCl的质量,最后使用质量分数的计算公式,求出样品中碳酸钙的质量分数和所用盐酸的质量分数
解答:解:(1)生成二氧化碳的质量=25 g+100 g-116.2 g=8.8 g
设:样品中CaCO3的质量为x,所用稀盐酸中HCl的质量为y.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73 44
x y 8.8 g
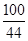 =
=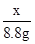
x=20 g
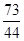 =
=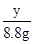
y=14.6 g
样品中碳酸钙的质量分数=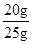 ×100%=80%
×100%=80%
所用稀盐酸中溶质的质量分数=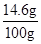 ×100%=14.6%
×100%=14.6%
答:(1)生成二氧化碳的质量为8.8 g
(2)样品中碳酸钙的质量分数为80%
(3)所用稀盐酸中溶质的质量分数为14.6%.
点评:根据化学方程式进行计算时,只能使用纯净物的质量进行计算,而不能把混合物的质量直接代入化学方程式进行计算.
