一天,老师给了小粱一包含有氯化钠杂质的氯化钙粉末,让他探究氯化钙的
质量分数,小粱进行了如下探究:称取该粉末6.7g.把它完全溶于88.3g水中,然后向所
得溶液中滴加质量分数为l0.6%的碳酸钠溶液,反应完全后,得到5g沉淀,请按要求回
答问题:
(1)所加碳酸钠溶液质量与产生沉淀质量的关系图是 (填序号)
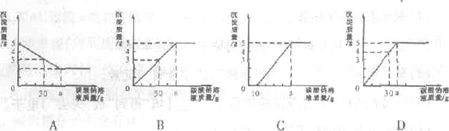
(2)这包混合物粉末中氯化钙的质量分数是 。(精确到0.1%)
(3)当混合物中氯化钙和碳酸钠恰好完全反应时,所得溶液中溶质的质量分数是多少?(要求写出计算过程)
(1)B(2分) (2)82.8%(2分)
(3)解:设氯化钙粉末中氯化钙的质量是x,氧化钙溶液与碳酸钠溶液恰好完全反应时,参加反应的碳酸钠的质量是y,生成氯化钠的质量为z
CaCl2 + Na2CO3 = 2NaCl + CaCO3↓ ……………………(1分)
111 106 117 100
x y z 5g
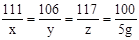
解得 x = 5.55g y = 5.3g z = 5.85g ………………(1分)
恰好完全反应时所需碳酸钠溶液的质量: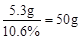
反应后溶质的质量:6.7-5.55g+5.85g=7g ………………(0.5分)
反应后溶液的质量:6.7g+88.3g+50g-5g=140g ………………(0.5分)
反应后溶液的质量分数: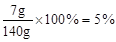 ………………(1分)
………………(1分)
答:(略)
分析:(1)根据只要向溶液中加入碳酸钠溶液就会产生碳酸钙沉淀;根据反应方程式以及碳酸钙的质量即可求得参加反应的碳酸钠溶质的质量,再根据溶质质量分数即可求得碳酸钠溶液的质量;据此即可判定那幅图正确;
(2)由图象可知,当生成沉淀的质量为5克时,食盐中的氯化钙恰好完全反应;根据此时沉淀的质量可求得氯化钙的质量;再根据样品质量与氯化钙质量即可求得样品中氯化钙的质量分数;
(3)根据方程式求得生成氯化钠的质量,再根据质量守恒定律可以求得反应后溶液的总质量;最后即可求得所得溶液中溶质的质量分数.
解:(1)设产生5g沉淀时,参加反应的碳酸钠的质量为w,
CaCl2+Na2CO3=2NaCl+CaCO3↓
106 100
w 5g
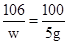 ,
,
解得:w=5.3g;
则需要碳酸钠溶液的质量为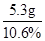 =50g;
=50g;
同理当产生3g沉淀时需要碳酸钠溶液的质量为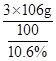 =30g;
=30g;
故B符合题意.
故答案为:B.
(2)设氯化钙粉末中氯化钙的质量是x,氧化钙溶液与碳酸钠溶液恰好完全反应时,参加反应的碳酸钠的质量是y,生成氯化钠的质量为z
CaCl2+Na2CO3=2NaCl+CaCO3↓
111 106 117 100
x y z 5g
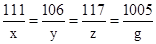
解得 x=5.55g y=5.3g z=5.85g
则这包混合物粉末中氯化钙的质量分数
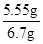 ×100%=82.8%;
×100%=82.8%;
故答案为:82.8%.
(3)恰好完全反应时所需碳酸钠溶液的质量: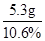 =50g
=50g
反应后溶质的质量:6.7-5.55g+5.85g=7g;
反应后溶液的质量:6.7g+88.3g+50g-5g=140g;
则反应后溶液的质量分数: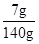 ×100%=5%
×100%=5%
答:当混合物中氯化钙和碳酸钠恰好完全反应时,所得溶液中溶质的质量分数是5%.
点评:对于带有图象或图表的计算题,在近年的中考中出现频度较高,能对图象或图表进行分析得出所需信息是解题的关键.根据质量守恒定律,反应后所得溶液的质量=所取6.7g固体样品+溶解所用的88.3g水+消耗10.6%的碳酸钠溶液的质量50g-生成沉淀碳酸钙的质量5g.
