问题
计算题
黄铜是铜和锌的合金(Cu-Zn),可用来制造电器零件及日用品。为测定某黄铜样品中铜的质量分数(不考虑黄铜中其他杂质),当向l0g黄铜样品粉末中加入98 g稀硫酸时恰好完全反应,称得烧杯中物质的质量为107.9g。请计算:
(1)反应生成氢气的质量为 g。
(2)此黄铜样品中铜的质量分数。
答案
(1)0.1 …………………………………………………………………………(1分)
(2)解:设样品中Zn的质量为x。
Zn + H2SO4 = ZnSO4 + H2↑ ………………………… ………(1分)
65 2
x 0.1g
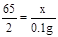 ………………………………………………(1分)
………………………………………………(1分)
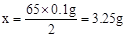 ……………………………………(1分)’
……………………………………(1分)’
铜的质量分数为 ………………………(1分)
………………………(1分)
答:黄铜样品中铜的质量分数为67.5%。
根据质量守恒定律可知产生氢气的质量为减少的质量即l0g+98 g-107.9g=0.1g。
设样品中Zn的质量为x。
Zn + H2SO4 = ZnSO4 + H2↑
65 2
x 0.1g
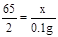
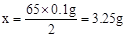 ’
’
铜的质量分数为
答:黄铜样品中铜的质量分数为67.5%。
