问题
计算题
在实验室易燃品橱柜里有一瓶失去标签的试剂,某化学兴趣小组三位同学为探究其组成,进行如下实验并进行分析:
(1)甲同学取物质3.6g在足量的氧气中燃烧。经测定得到5.4g水和11g二氧化碳,通过计算求出5.4g水中含氢元素 g,11g二氧化碳中含碳元素 g。
(2)乙同学分析了乙同学的计算结果,认为还可以计算出该物质中碳、氢元素的原子个数比是 。
答案
(1)甲 0.6 g, 3 g。(2) 5:12
分析:(1)根据质量守恒定律可以判断出在该物质中一定含有碳元素和氢元素,然后根据元素的质量分数的求法,来反向求出碳元素和氢元素的质量,将碳元素和氢元素的质量的和与燃烧的物质的质量相比较,进而作出判断;
(2)根据(1)中计算的碳元素和氢元素的质量结合相对原子质量来求算出碳原子和氢原子的质量之比.
解:(1)由于该物质在氧气中燃烧生成了二氧化碳和水,说明该物质中一定含有碳、氢元素;由于3.6g该物质燃烧生成的5.4g水中氢元素的质量为:5.4g×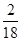 ×100%=0.6g,11g二氧化碳中碳元素的质量为:11g×
×100%=0.6g,11g二氧化碳中碳元素的质量为:11g×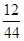 ×100%=3g,因此根据质量守恒定律可知,该物质也含有3g碳元素、0.6g氢元素,正好等于该物质的质量,因此该物质中只含有碳、氢两种元素;
×100%=3g,因此根据质量守恒定律可知,该物质也含有3g碳元素、0.6g氢元素,正好等于该物质的质量,因此该物质中只含有碳、氢两种元素;
(2)该物质中碳、氢元素的原子个数比为: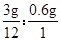 =5:12
=5:12
(1)0.6g;3g;
(2)5:12.
