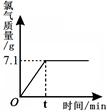
(8分)氯化钠是一种重要的化工原料。电解氯化钠溶液可制得氯气、氢氧化钠等物质,反应的化学方程式为2NaCl + 2H2O  Cl2↑+ H2↑+ 2NaOH。现取一定质量的氯化钠溶液进行电解,当氯化钠恰好完全反应时,得到51.2 g溶液,生成氯气的质量与时间的关系如图所示。请计算:
Cl2↑+ H2↑+ 2NaOH。现取一定质量的氯化钠溶液进行电解,当氯化钠恰好完全反应时,得到51.2 g溶液,生成氯气的质量与时间的关系如图所示。请计算:
(1)氯化钠完全反应时,溶液中剩余水的质量。
(2)原氯化钠溶液中溶质的质量分数。
(3)若把这些氯化钠溶液稀释成溶质的质量分数为0.9%的生理盐水,需要加水的质量。
(共8分)解:(1)设消耗氯化钠的质量为x,生成氢氧化钠的质量为y,生成氢气的质量为z
2NaCl + 2H2O Cl2↑+ H2↑+ 2NaOH
Cl2↑+ H2↑+ 2NaOH
2×58.5 71 2 2×40
x 7.1 g z y
得方程 (2×58.5):71 =" x" :7.1 g (1分)
71:(2×40) =" 7.1" g :y (1分)
71:2 =" 7.1" g :z (1分)
解得 x =" 11.7" g y =" 8" g z =" 0.2" g
∴剩余水的质量:51.2 g – 8 g =" 43.2" g (1分)
(2)氯化钠溶液质量为:51.2 g + 7.1 g + 0.2 g =" 58.5" g (1分)
氯化钠溶液中溶质的质量分数为: 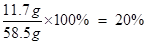
(1分)
(3)设稀释后生理盐水的质量为a
58.5 g×20% = a×0.9%
分析:据图可看出,氯化钠完全反应时可得到氯气7.1g.
(1)反应结束后所得溶液内包含氢氧化钠和水,根据氯气的质量可求出氢氧化钠的质量,再用反应结束后所得溶液的质量-氢氧化钠的质量即为溶液中剩余水的质量.
(2)原氯化钠溶液中溶质的质量分数= ×100%,氯化钠的质量可根据氯气的质量算出,根据质量守恒定律,氯化钠溶液的质量=氯气的质量+氢气的质量(可根据氯气的质量算出)+反应结束后所得溶液的质量.
×100%,氯化钠的质量可根据氯气的质量算出,根据质量守恒定律,氯化钠溶液的质量=氯气的质量+氢气的质量(可根据氯气的质量算出)+反应结束后所得溶液的质量.
(3)根据稀释前后溶液中溶质的质量不变列出等式.
解答:解:(1)设消耗氯化钠的质量为x,生成氢氧化钠的质量为y,生成氢气的质量为z
2NaCl+2H2O Cl2↑+H2↑+2NaOH
Cl2↑+H2↑+2NaOH
117 71 2 80
x 7.1g z y
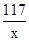 =
=
 =
=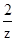
 =
=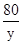
x=11.7g z=0.2g y=8g
剩余水的质量:51.2g-8g=43.2g
答:溶液中剩余水的质量为43.2g
(2)氯化钠溶液质量为:51.2g+7.1g+0.2g=58.5g
氯化钠溶液中溶质的质量分数为: ×100%=20%
×100%=20%
答:原氯化钠溶液中溶质的质量分数为20%.
(3)设稀释后生理盐水的质量为a
58.5 g×20%=a×0.9%
a="1300" g
需要加水的质量为:1300 g-58.5 g="1241.5" g
答若把这些氯化钠溶液稀释成0.9%的生理盐水,需要加水的质量为1241.5 g.
点评:稀释溶液的过程只是加水的过程,稀释前后溶液中溶质的质量不变,因此在做有关稀释溶液的计算题时可根据稀释前后溶液中溶质的质量不变列出等式.
