某研究小组为测定黄铜(铜锌合金)中锌的含量,用100 g黄铜和足量的稀盐酸反应.结果得到了12 g氢气。请问该黄铜中锌的质量分数是多少?(列出计算过程)
解:设该黄铜中锌的质量分数为x
Zn + 2HCl===ZnCl2 + H2↑ ………(1分)
65 2
100x g 1.2g
65/2=100xg/1.2 …………………… (2分)
x=39% ……………………… (2分)
答:该黄铜中锌的质量分数为39%。
分析:根据黄铜的成分可知锌能与稀盐酸反应,利用锌与盐酸反应的化学方程式将氢气的质量代入方程式来解答.
解答:解:设该黄铜中锌的质量为x,
Zn+2HCl═ZnCl2+H2↑
65 2
x 1.2g
65/2=100xg/1.2
解得x=39g,
又黄铜的质量为100g,
则该黄铜中锌的质量分数为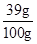 ×100%=39%,
×100%=39%,
答:该黄铜中锌的质量分数为39%.
点评:本题考查学生利用化学反应方程式的计算,学生只要明确只有锌与酸反应,然后将氢气的质量直接代入方程式即可解答
