下列有关溶液中微粒的物质的量浓度关系正确的是( )
A.在0.1mol·L-1NaHCO3溶液中:c(Na+)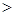 c(HCO3-)
c(HCO3-)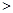 c(CO32-)
c(CO32-)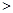 c(H2CO3)
c(H2CO3)
B.在0.1mol·L-1Na2CO3溶液中:c(OH-)= c(HCO3-)+c(H2CO3)+ c(H+)
C.向0.2 mol·L-1NaHCO3溶液中加入等体积0.1mol·L-1NaOH溶液:
c(CO32-)> c(HCO3-)> c(OH-)> c(H+)
D.常温下,CH3COONa和CH3COOH混合溶液呈中性, c(Na+)=0.1mol·L-1:c(Na+)= c(CH3COO-)> c(CH3COOH)> c(H+)= c(OH-)
答案:D
NaHCO3溶液中,既存在HCO3-的水解平衡,又存在HCO3-的电离平衡,且水解程度>电离程度
HCO3-+H2O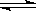 H2CO3+ OH- HCO3-
H2CO3+ OH- HCO3-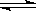 H++ CO32-,
H++ CO32-,
则应:c(Na+)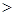 c(HCO3-)
c(HCO3-)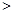 c(H2CO3)
c(H2CO3)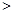 c(CO32-),故A错误;
c(CO32-),故A错误;
Na2CO3溶液中,存在着CO32-的水解平衡:CO32-+ H2O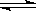 HCO3-+ OH- HCO3-+H2O
HCO3-+ OH- HCO3-+H2O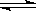 H2CO3+ OH-,
H2CO3+ OH-,
由质子守恒,得:c(OH-)= c(HCO3-)+2c(H2CO3)+ c(H+),故B错误;
NaHCO3+NaOH= Na2CO3+H2O
1 1 1
0.1V 0.1V 0.1V
所以,选项C变为等浓度(均为0.05 mol·L-1)的NaHCO3、Na2CO3溶液的混合物,主要考虑以下水解平衡:HCO3-+H2O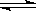 H2CO3+ OH- CO32-+ H2O
H2CO3+ OH- CO32-+ H2O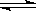 HCO3-+ OH-,且等浓度的HCO3-、CO32-,后者的水解程度大(因HCO3-的水解相当于CO32-的第二步水解),故应c(HCO3-)> c(CO32-)>c(OH-)> c(H+),则C错误;
HCO3-+ OH-,且等浓度的HCO3-、CO32-,后者的水解程度大(因HCO3-的水解相当于CO32-的第二步水解),故应c(HCO3-)> c(CO32-)>c(OH-)> c(H+),则C错误;
CH3COONa和CH3COOH的混合溶液中,存在CH3COOH的电离平衡和CH3COO-的水解平衡:
CH3COOH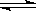 CH3COO-+H+ CH3COO-+ H2O
CH3COO-+H+ CH3COO-+ H2O 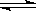 CH3COOH+ OH-,
CH3COOH+ OH-,
且CH3COOH的电离平衡>CH3COO-的水解平衡,所以:c(CH3COO-)> c(CH3COOH),
再利用电荷守恒,得:c(Na+)+ c(H+)= c(OH-)+ c(CH3COO-),且混合溶液呈中性,则:c(H+)= c(OH-),
推出:c(Na+)= c(CH3COO-),故D正确
