(2011年江西南昌,24题)某地一辆满载浓硫酸的罐车翻到,导致25t溶质的质量分数为98%的浓硫酸泄漏,并向路基两边蔓延,接到报警后消防官兵立即赶来并用石灰浆(主要成分为氢氧化钙)中和硫酸解除了险情。请回答:
(1)25t溶质的质量分数为98%的浓硫酸中含H2SO4的质量为 ;
(2)计算:中和泄漏的硫酸,理论上需要多少吨氢氧化钙;
(3)处理一定量的硫酸,理论上既可用m1吨的氢氧化钙粉末,也可选用m2吨的氧化钙粉
末,还可用m3吨碳酸钙粉末,则m1、m2、 m3的数值大小关系为 。
(1) 24.5t
(2) 解:设理论上需要氢氧化钙的质量为x
H2SO4 + Ca(OH)2 ="==" CaSO4 + 2H2O
98 74
24.5t x
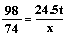 x=18.5t
x=18.5t
答:理论上需要氢氧化钙的质量为 18.5t。
(3) m3>m1>m2
分析:稀释前后的硫酸溶液中,硫酸的质量是不变的,所以,中和掉的硫酸就是25吨98%的浓硫酸中的硫酸;根据反应的化学方程式,由硫酸的质量计算氢氧化钙的质量.一定量的硫酸分别与氢氧化钙粉末、氧化钙粉末、碳酸钙粉末完全反应后,经过化学方程式的计算得出氢氧化钙粉末、氧化钙粉末、碳酸钙粉所消耗的质量关系如何.
解答:解:(1)25t质量分数为98%的浓硫酸中硫酸的质量=25t×98%=24.5t
(2)设理论上需要氢氧化钙的质量为x
Ca(OH)2+H2SO4=CaSO4+2H2O
74 98
x 24.5t
74:98=x:24.5t
解之得 x=18.5t
答:中和泄漏的硫酸,理论上需要约18.5吨氢氧化钙.
(3)设一定量硫酸的质量为m,分别与m1吨氢氧化钙粉末、m2吨氧化钙粉末、m3吨碳酸钙粉末恰好完全反应.
Ca(OH)2+H2SO4=CaSO4+2H2O CaO+H2SO4=CaSO4+H2O CaCO3+H2SO4=CaSO4+H2O+CO2↑
74 98 56 98 100 98
m1t m m2t m m3t m
74:98=m1t:m 56:98=m2t:m 100:98=m3t:m
解之得m1=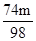 t
t
解之得m2=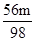 t
t
解之得m3=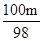 t
t
则m1、m2、m3的数值大小关系为:m3>m1>m2
答:m1、m2、m3的数值大小关系为:m3>m1>m2.
故答案为:
(1)24.5t
(2)解:设理论上需要氢氧化钙的质量为x
H2SO4+Ca(OH)2═CaSO4+2H2O
98 74
24.5 x
74:98=x:24.5t
x=18.5t
(3)m3>m1>m2
