(8分)氯化钙钾石的化学式为KCl·xCaC12(x是CaCl2的系数)。它是一种天然的钾肥,溶于水后得到KCl与CaCl2的混合溶液。某化学兴趣小组为了测定氯化钙钾石中钾元素的质量分数,称取样品18.55g加水完全溶解得到KCl与CaCl2的混合溶液,向该溶液中逐滴加入Na2CO3溶液,产生的沉淀与加入Na2CO3溶液的质量关系如下图所示。请回答下列问题:

(1)写出Na2CO3与CaCl2反应的化学方程式 ▲ 。
(2)图中AB段表示的意义是 ▲ 。
(3)18.55g氯化钙钾石样品中:
①CaCl2的质量是 ▲ g;
②KCl的质量是 ▲ g;
③钾元素的质量分数是 ▲ 。
(4)所用N a2CO3溶液中溶质的质量分数是多少?(最后一问要求写出计算过程)
(8分)
(1) Na2CO3+CaCl2=CaCO3↓+2NaCl (1分)
(2) CaCl2已完全反应,且Na2CO3溶液过量 (1分)
(3) 11.1 7.45 21.0% (3分)
(4) 解:设106gNa2CO3溶液中Na2CO3的质量为x
Na2CO3+CaCl2=CaCO3↓+2NaCl (1分)
106 100
x 10g
106:100=x:10g (1分)
x=10.6g
该所用Na2CO3溶液中Na2CO3的质量分数=10.6g/106g×100%=10% (1分)
答:所用Na2CO3溶液中Na2CO3的质量分数为10%
分析:(1)碳酸钠与氯化钙都属于盐类物质,盐与盐可发生复分解反应,碳酸钠与氯化钙交换成分生成碳酸钙沉淀和氢化钠;
(2)图中AB段沉淀质量不变,说明溶液中的氯化钙已完全反应,加入的碳酸钠溶液过量,不再发生反应;
(3)根据碳酸钠与氯化钙生成的碳酸钙沉淀,计算出参加反应的氯化钙的质量;样品质量与氯化钙质量差即氯化钾的质量;氯化钾中钾元素质量与样品质量比可计算样品中钾元素的质量分数;
(4)利用恰好完全反应时所加入的106g碳酸钠溶液中的碳酸钠质量与溶液质量比计算所用溶液的溶质质量分数;其中碳酸钠的质量可根据反应的化学方程式由生成成沉淀碳酸钙的质量计算.
解答:解:(1)加入的碳酸钠与溶液中氯化钙交换成分,因形成沉淀而发生反应,生成碳酸钙沉淀和氯化钠;
故答案为:Na2CO3+CaCl2=CaCO3↓+2NaCl;
(2)AB段沉淀碳酸钙的质量没有改变,表示溶液中氯化钙已完全反应,继续加入的碳酸钠溶液过量;
故答案为:CaCl2已完全反应,且Na2CO3溶液过量;
(3)设恰好完全反应生成10g碳酸钙沉淀时消耗氯化钙的质量为m
Na2CO3+CaCl2=CaCO3↓+2NaCl
111 100
m 10g
 =
=
m=11.1g
18.55g氯化钙钾石样品中KCl的质量=18.55g-11.1g=7.45g
18.55g氯化钙钾石样品中钾元素的质量分数=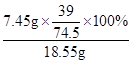 ×100%≈21.0%
×100%≈21.0%
故答案为:11.1;7.45;21.0%;
(4)设106gNa2CO3溶液中Na2CO3的质量为x
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100
x 10g
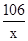 =
=
x=10.6g
该所用Na2CO3溶液中Na2CO3的质量分数=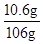 ×100%=10%
×100%=10%
答:所用Na2CO3溶液中Na2CO3的质量分数为10%
点评:对变化的曲线进行分析时,曲线折点表示两物质此时恰好完全反应,折点后曲线不再上升,说明所加入的反应物不再发生反应而过量.
