(5分)过氧化钠(Na2O2)与水发生反应,生成对应的碱和氧气,化学方程式为:
2Na2O2+2H2O=4NaOH+O2↑。现将78 g过氧化钠放入338 g水中,充分反应。试计算:
(1)生成的氧气在标准状况的体积是多少?(已知标准状况下氧气的密度是1.43g/L)
(2)所得溶液中溶质质量分数是多少?
解:设生成O2和NaOH的质量分别为x和y
2Na2O2 + 2H2O = 4NaOH + O2↑
156 160 32
78g y x
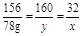
x="16" g
y="80" g
故O2在标准状况下的体积为: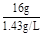 =" 11.2" L
=" 11.2" L
NaOH溶液中NaOH的质量分数为: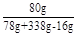 ×100% =20%
×100% =20%
分析:(1)根据反应物两反应物的质量关系,判断完全反应的物质为过氧化钠,根据反应化学方程式,由完全反应的过氧化钠质量计算生成氧气的质量并换算成体积;
(2)反应后所得溶液为氢氧化钠溶液,根据反应的化学方程式计算出溶质氢氧化钠的质量,根据质量守恒定律计算出所得溶液质量,两个质量比可计算所得溶液中溶质质量分数.
解答:解:根据反应的化学方程式可知反应中过氧化钠与水的质量比为156:36,因此,将78g过氧化钠放入338g水中,充分反应时过氧化钠完全反应,
设生成O2和NaOH的质量分别为x和y
2Na2O2+2H2O=4NaOH+O2↑
156 160 32
78g y x
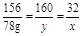
解之得x=16g,y=80g
(1)故O2在标准状况下的体积为:
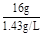 =11.2L
=11.2L
(2)NaOH溶液中NaOH的质量分数为:
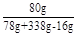 ×100%=20%
×100%=20%
答:(1)生成的氧气在标准状况的体积是11.2L;(2)所得溶液中溶质质量分数是20%.
点评:根据反应的化学方程式进行计算时,所使用的物质的质量必须为完全反应的物质的质量,未参加反应的物质质量不能代入化学方程式进行计算.

 _____;
_____;