问题
计算题
(2011年四川绵阳,37题)我市有丰富的石灰石资源,为了测定某地石灰石中碳酸钙的质量分数,取7、5g样品放入烧杯,加入稀盐酸至恰好不再产生气体时消耗盐酸34、7g,放出的气体在常温下体积为1、1L。
(1)常温下CO2气体的密度为2、0g/L,则上述反应放出气体的质量为_________g。
(2)若石灰石中的杂质均不溶于水且不与盐酸反应,计算石灰石中CaCO3的质量分数和反应所得溶液中溶质的质量分数(计算最终结果保留1位小数)。
答案
(1)2、2
(2)解:7、5g石灰石样品中含有CaCO3的质量为X,反应生成CaCl2的质量为Y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 111 44
X Y 2、2g
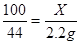
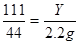
X="5g " Y=5、55g
石灰石中CaCO3的质量分数为: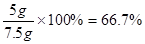
反应所得溶液中溶质的质量分数为: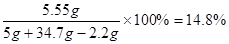
答:石灰石中CaCO3的质量分数为66、7%,反应所得溶液中溶质的质量分数为14、8%。

