(2010浙江嘉兴39)电动自行车、小汽车等交通工具中都有为其提供电能的铅蓄电池(又称“电瓶”),它的优点
是可以充电循环使用。电瓶的正极材料是二氧化铅(PbO2),负极材料是金属铅(Pb),电瓶内所加液体是溶质质量分数为36%的稀硫酸,放电(为外界供电)时发生反应的化学方程式如下:
PbO2 (固)+ 2H2SO4 + Pb = 2PbSO4 ↓+ 2H2O
当放电时,反应物反应掉一定量后,就会导致电压下降,不能正常使用,这时就必须及时充电。
(1)电瓶在放电时, ▲ 能转化为电能。
(2)假如某个电瓶中铅的质量为1800克,内装36%的稀硫酸1200克,当有310.5克的铅参加反应时,需消耗稀硫酸中溶质多少克?此时电瓶中硫酸溶液溶质的质量分数是多少?
(最后结果保留两位小数)
(1)化学………………………………………………………………(1分)
(2)解:设需消耗纯稀硫酸x克,同时生成水y克。
PbO2 (固)+ 2H2SO4 + Pb = 2PbSO4 ↓+ 2H2O
196 207 36
x 310.5克 y
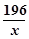 =
=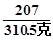 x =294克 …………………………………(2分)
x =294克 …………………………………(2分)
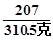 =
= 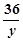 y=54克 …………………………………(1分)
y=54克 …………………………………(1分)
原来m溶质=1200克×36%=432克 剩余m溶质=432克-294克=138克…………(1分)
剩余m溶液=1200克-294克+54克=960克 ………………………………………(1分)
剩余H2SO4 %=138克/960克="14.38% " ……………………………………………(1分)
答:需消耗稀硫酸中溶质为294克,此时电瓶中硫酸溶液中溶质的质量分数是14.38%。
(其他合理解法也给分)
