(7分)26g黄铜(Cu-Zn合金)与100g稀硫酸在烧杯中恰好完全反应,反应后测得烧杯中剩余物的总质量为125.8克。求:⑴黄铜中铜的质量分数;⑵反应后所得溶液中溶质质量分数。(计算结果精确到0.1%)
解:氢气的质量为0.2克。
设锌的质量为X,
Zn+ H2SO4 = ZnSO4+ H2↑
65 161 2
X Y 0.2g
65:X=2:0.2g X=6.5g
161:Y=2:0.2g Y=16.1g
黄铜中铜的质量分数: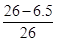 ×100%=75%
×100%=75%
反应后所得溶液中溶质质量分数: ×100%=15.1%
×100%=15.1%
答:黄铜中铜的质量分数为75% 反应后所得溶液中溶质质量分数为15.1%
分析:(1)烧杯中总物质前后减少的质量为氢气的质量,利用锌和硫酸反应的化学方程式,根据氢气的质量求出锌的质量,进而求出铜的质量,最后根据  ×100%求出黄铜中铜的质量分数.
×100%求出黄铜中铜的质量分数.
(2)反应后所得溶液中溶质的质量分数=  ×100%,溶质是硫酸锌,可根据氢气的质量求出,反应后所得溶液的质量可用锌的质量+稀硫酸的质量-氢气的质量算出.
×100%,溶质是硫酸锌,可根据氢气的质量求出,反应后所得溶液的质量可用锌的质量+稀硫酸的质量-氢气的质量算出.
解答:解:氢气的质量=26g+100g-125.8g=0.2g.
设锌的质量为x,生成硫酸锌的质量为y.
Zn+H2SO4=ZnSO4+H2↑
65 161 2
x y 0.2g
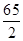 =
=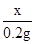
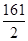 =
=
x=6.5g y=16.1g
(1)黄铜中铜的质量分数:
 ×100%=75%
×100%=75%
答:黄铜中铜的质量分数为75%
(2)反应后所得溶液中溶质质量分数: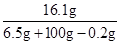 ×100%=15.1%
×100%=15.1%
答:反应后所得溶液中溶质质量分数为15.1%
点评:本题中反应后所得溶液的质量算法比较多,除了题中的那种算法外还可以用黄铜的质量+稀硫酸的质量-铜的质量-氢气的质量算出,也可以用反应后烧杯中剩余物质的总质量-铜的质量算出.
