(16分)在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)常温下将0.01 mol NH4Cl和0.002 mol NaOH溶于水配成1L溶液。
①溶液中浓度为0.01 mol·L-1的离子是 。
②物质的量之和为0.01 mol的两种粒子是 和 。
(2)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 (填“碱性”、“酸性”或“中性”),醋酸体积 氢氧化钠溶液体积(填“>”、“<”或“=”)。
(3)将m mol·L-1的醋酸和n mol·L-1的氢氧化钠溶液等体积混合后溶液的pH=7, m与n的大小关系是m n。(填“>”、“<”或“=”)
(4)浓度为0.100 mol·L-1的下列各物质的溶液中,c(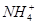 )由大到小的顺序是
)由大到小的顺序是
①NH4Cl ②NH4HSO4 ③NH3·H2O ④CH3COONH4
(5)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A=H++HA- HA- H++A2-
H++A2-
已知0.1 mol·L-1的NaHA溶液pH=2,则0.1 mol·L-1的H2A溶液中氢离子的物质的量浓度
0.11 mol·L-1(填“>”“=”或“<”)。
(1)Cl- NH4+ NH3·H2O (2)中性 > (3)>
(4)②>①>④>③ (5)<
(1)溶于水后发生反应NH4Cl+NaOH=NaCl+NH3·H2O,根据已知数据可知氢氧化钠是不足的。但根据氯原子守恒可知氯离子的浓度是0.01mol/L。同样根据氮原子守恒可知,NH4+ 和NH3·H2O的浓度之和一定是0.01mol/L。
(2)根据电荷守恒可知c (Na+)+ c (H+) =c (OH-)+ c (CH3COO-),醋酸根离子和钠离子浓度相等,则c (H+) =c (OH-),所以溶液显中性。醋酸属于弱酸,如果醋酸和氢氧化钠恰好反应,则溶液一定显碱性,因此只有醋酸过量,溶液才能显中性。
(3)分析见(2)
(4)NH4+水解显酸性,硫酸氢铵能电离出氢离子,抑制醋酸的电离。醋酸根水解显碱性,促进NH4+水解。氨水是弱电解质,电离出的Na4+最小。
(5)根据电离方程式可知,该二元酸的第一步电离是完全电离,但第二步电离存在电离平衡。0.1 mol·L-1的H2A溶液中第一步电离出的氢离子和HA-的浓度均是0.1mol/L的,由于电离出的氢离子可以抑制HA-的电离,所以0.1 mol·L-1的H2A溶液中氢离子的物质的量浓度小于0.11mol/L。
