(6分)张南同学想测定赤铁矿中氧化铁的质量分数,做法如下,请回答下列问题。
(1)配制稀硫酸。
①配制200g 19.6%的稀硫酸,需要98%的浓硫酸的体积是 ;

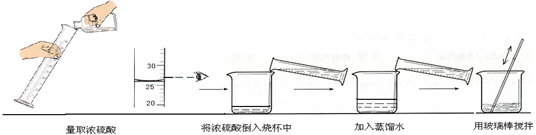
②下图实验过程中出现操作的错误是 。
(2)将赤铁矿粉末,用稀硫酸溶解,反应的化学方程式是 ;
(3)取20g的赤铁矿粉末恰好与l50g的19.6%的稀硫酸完全反应,求解生成硫酸铁质量(x)的比例式为 ;
(4)此赤铁矿中氧化铁的质量分数为 ;
(5)向反应后所得溶液中加入34g水,则所得溶液溶质的质量分数是
(1)① 26mL ②读数的方式错误;浓硫酸和水加入的顺序颠倒。
(2)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
(3)294/400=29.4g/x
(4)80%
(5)20%
(1)①需要98%的浓硫酸的体积是=200g×19.6%÷98%÷1.6g/cm3=25mL.
故答案为:25mL;②用量筒量取液体读数时视线要与凹液面的最低处保持水平,稀释浓硫酸时要先加水,然后将浓硫酸注入水中,所以答案为:读数的方式错误;浓硫酸和水加入的顺序颠倒
(2)赤铁矿的主要成分为三氧化二铁,三氧化二铁与硫酸反应生成硫酸铁和水;故答案为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(3)设生成硫酸铁质量x
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
294 400
150g×19.6% x
故答案为:
294:400=50g×19.6%:x;
(4)设氧化铁的质量为y
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
160 294
Y 150g×19.6%
160:294= Y:150g×19.6%
y=16g
赤铁矿样品中氧化铁的质量分数为:16g/20g×100%=80%.
故答案为:80%;
(5)向反应后所得溶液中加入34g水,则最终所得溶液中溶质的质量分数是20%.
故答案为:20%