Ⅰ.在一容积为2 L的密闭容器内加入2 mol的CO和6 mol的H2,在一定条件下发生如下反应:CO(g)+ 2H2(g) CH3OH(g);ΔH
CH3OH(g);ΔH
(1)反应达到平衡时, CH3OH的物质的量浓度可能为______。
A.0.9 mol/L B.1.0 mol/L C.1.5 mol/L
若经过3分钟,CH3OH达到了以上浓度,则VCO=__________
该反应的化学平衡常数是____________。
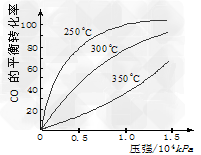
(2) CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH________0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右 ,选择此条件的理由是
______________________。
Ⅱ.已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。
(1)用离子方程式解释Na2C2O4溶液显碱性的原因____________________;
(2)常温下,向10 m L 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系________________ ;
(3)称取6.0g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解配成250 mL 溶液。量取两份此溶液各25 mL,分别置于两个锥形瓶中 。第一份溶液中加入2滴酚酞试液,滴加0.25mol·L-1 NaOH 溶液至20mL时,溶液由无色变为浅红色。第二份溶液滴加0.10 mol·L-1 酸性KMnO4溶液至16mL时反应完全。则原试样中H2C2O4·2H2O的的质量分数为_______ 。
Ⅰ(1)A;0.3mol·L-1·min-1 ;1/16 或0.0625
(2)<;在250℃、1.3×104kPa下,CO的转化率已经很高,增加压强CO的转化率提高不大,而生产成本却会显著增加(或经济效益不好)
Ⅱ(1)C2O42-+H2O HC2O4- +OH-;
HC2O4- +OH-;
(2)c(Na+)> c(HC2O4-)> c(H+)> c(C2O42-) > c(OH-)
(3)21%。
