问题
选择题
下列电解质溶液的有关叙述正确的是
A.同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7
B.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
C.含l mol KOH的溶液与l mol CO2完全反应后,溶液中c(K+)=c(HCO3-)
D.在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-)
答案
答案:D
强酸和强碱有一元、二元之分,故同浓度同体积的强酸和强碱必须元数相同时,混合后pH才等于7,A错;硫酸钡在水中存在溶解平衡:BaSO4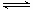 Ba2++SO42-,故加入硫酸钠固体时,c(Ba2+)变小,B错;溶质为1mol的氢氧化钾溶液和1mol二氧化碳反应,恰好全部生成KHCO3,但由于HCO3-在水溶液中即存在电离也存在水解,故c(K+)= c(HCO3-),C错;醋酸钠属于强碱弱酸盐,其水溶液呈碱性,故加入适量醋酸,能使其呈中性,此时溶液中c(Na+)= c(CH3COO-),D对。
Ba2++SO42-,故加入硫酸钠固体时,c(Ba2+)变小,B错;溶质为1mol的氢氧化钾溶液和1mol二氧化碳反应,恰好全部生成KHCO3,但由于HCO3-在水溶液中即存在电离也存在水解,故c(K+)= c(HCO3-),C错;醋酸钠属于强碱弱酸盐,其水溶液呈碱性,故加入适量醋酸,能使其呈中性,此时溶液中c(Na+)= c(CH3COO-),D对。
考点定位:此题综合考查了水溶液中的离子平衡知识。
